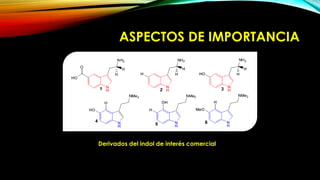
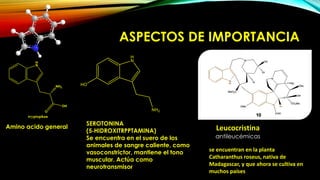
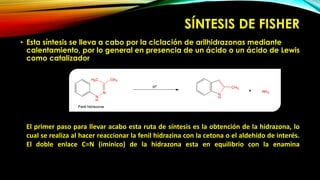
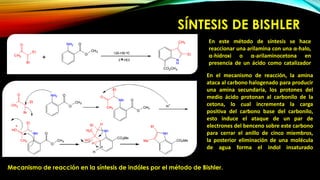
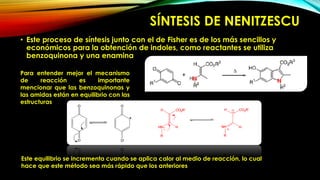
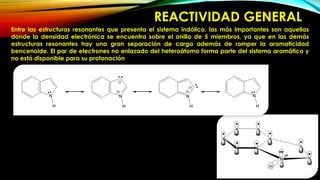
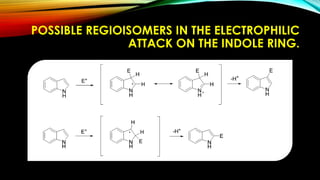
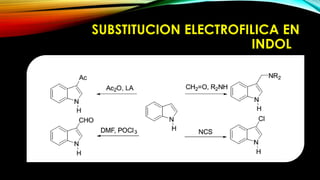
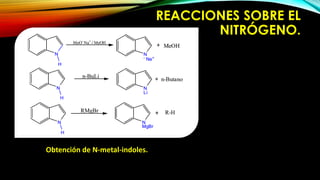
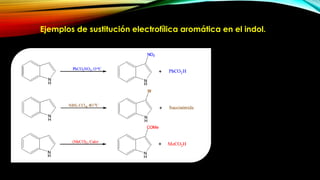
El indol es un compuesto aromático pirrol fusionado al benceno. Existen varios métodos para su síntesis, como la síntesis de Fisher, Madelung, Bishler y Nenitzescu. El indol lleva a cabo reacciones de sustitución electrofílica aromática preferentemente en las posiciones 2 y 3 del anillo heterocíclico. Derivados importantes del indol incluyen la serotonina, ergotamina y ácido lisérgico.