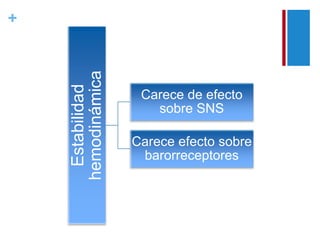
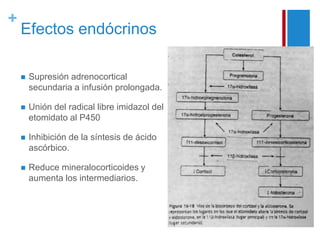
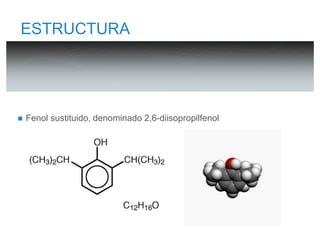
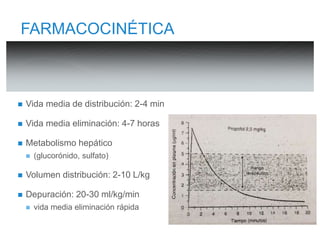
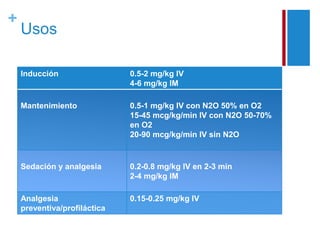
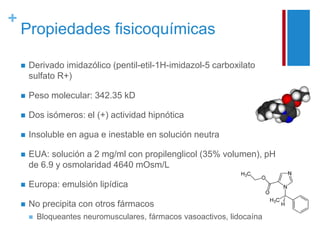
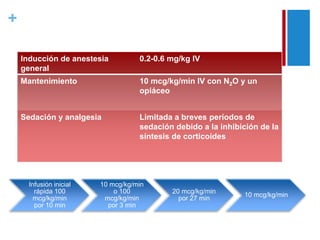
El documento describe las propiedades y usos del propofol y otros inductores de la anestesia general como la ketamina y el etomidato. El propofol es un sedante hipnótico altamente lipofílico que se usa comúnmente para la inducción y mantenimiento de la anestesia. La ketamina produce anestesia disociativa y una analgesia profunda sin depresión cardiovascular o respiratoria significativa. El etomidato proporciona estabilidad hemodinámica y mínima depresión respiratoria pero puede inhibir temporalmente la sí

































![+
SNC
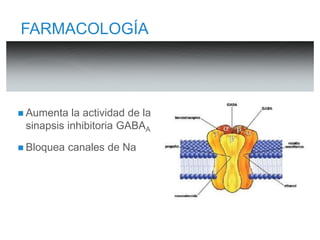
Principal efecto: Hipnosis
No actividad analgésica
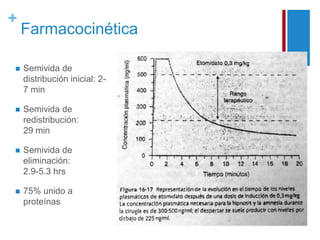
[ ] plasmática para mantenimiento 300-500 ng/ml
Sedación: 150-300 ng/ml
Despertar: 150-250 ng/ml
Mecanismo de acción similar al propofol,
subunidades B2 y B3 del receptor GABAA](https://image.slidesharecdn.com/inductores-141006202126-conversion-gate01/85/Inductores-Anestesicos-44-320.jpg)