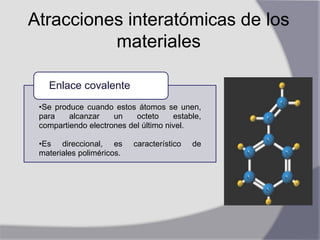
Un átomo es la unidad más pequeña de un elemento químico y está compuesto de un núcleo con protones y neutrones rodeado por electrones. El átomo se une a otros átomos a través de enlaces iónicos, covalentes o metálicos dependiendo de si comparten o transfieren electrones. Los átomos se organizan en una red cristalina con celdas unitarias como las estructuras cúbica centrada en el cuerpo, cúbica centrada en las caras o hexagonal compacta.