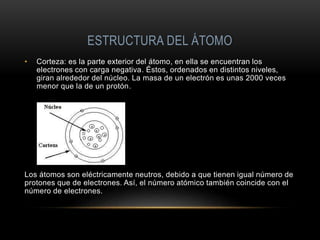
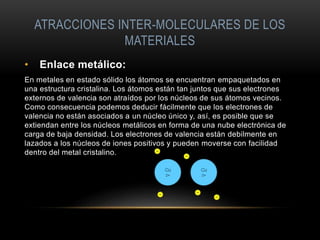
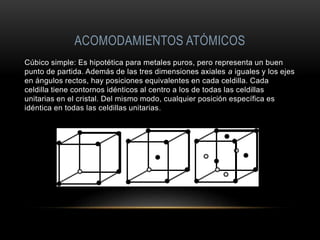
El documento describe la estructura atómica de los materiales. Explica que los átomos tienen un núcleo central con protones y neutrones, y electrones en la corteza. Describe los diferentes tipos de enlaces entre átomos como iónico, covalente y metálico. También cubre las fuerzas intermoleculares y los diferentes acomodamientos atómicos cristalinos como cúbico simple, cúbico de caras centradas y cúbico de cuerpos centrados.