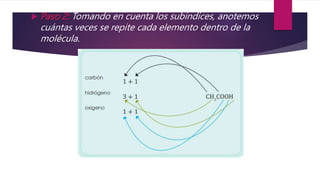
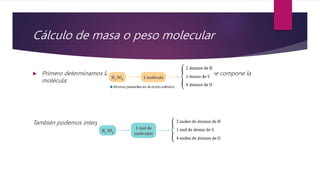
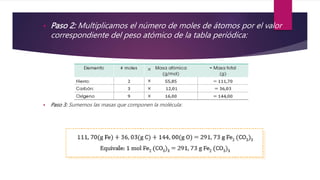
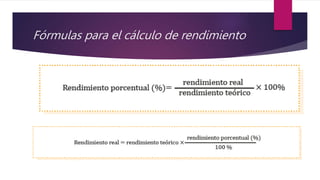
Este documento explica conceptos relacionados con la masa molecular y la estequiometría. Define una molécula y explica el uso de subíndices. Luego, describe cómo calcular la masa molecular de un compuesto químico usando los pesos atómicos y el número de átomos de cada elemento. Finalmente, explica cómo convertir entre masa, moles y número de moléculas usando la constante de Avogadro.