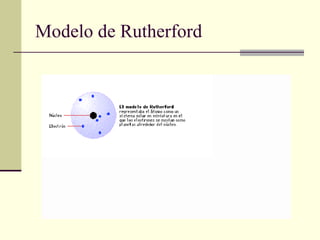
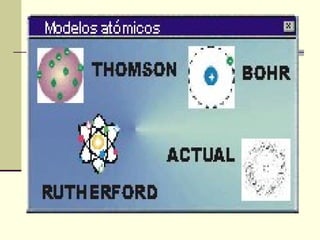
El documento introduce los modelos atómicos de Dalton, Thomson, Rutherford y Bohr. El modelo de Dalton establece que la materia está compuesta de átomos indivisibles e idénticos dentro de un mismo elemento. El modelo de Thomson propone que el átomo está formado por una esfera de carga positiva con electrones incrustados. El modelo de Rutherford introduce el núcleo central con electrones orbitando alrededor. El modelo de Bohr corrige las inconsistencias de Rutherford al proponer que los electrones solo pueden orbitar en órbitas cuánticas discret