El documento describe las propiedades de los estafilococos, incluyendo Staphylococcus aureus. Explica que los estafilococos son cocos grampositivos que se agrupan en racimos y colonizan la piel humana. S. aureus es una de las especies más comunes que causa una amplia gama de infecciones, desde infecciones de la piel hasta enfermedades sistémicas potencialmente mortales.



![STAPHYLOCOCCUS Y COCOS GRAMPOSITIVOS RELACIONADOS 177
©
Elsevier.
Fotocopiar
sin
autorización
es
un
delito.
polimorfonucleares. En presencia de anticuerpos específicos
frente a los estafilococos, el exceso de C3 se liga a las bac-
terias, lo que lleva a su fagocitosis. La capa de limo también
interfiere con la fagocitosis de las bacterias. La capacidad de
la proteína A de ligarse a las inmunoglobulinas evita de forma
eficaz la eliminación inmunitaria mediada por anticuerpos
de S. aureus. La proteína A extracelular también puede
unirse a los anticuerpos, formando inmunocomplejos con el
consiguiente consumo del complemento.
Toxinas estafilocócicas
S. aureus produce un gran número de toxinas, entre las que
figuran cinco toxinas citolíticas que dañan la membrana
(alfa, beta, delta, gamma y leucocidina de Panton-Valentine
[P-V]),dostoxinasexfoliativas(AyB),18enterotoxinas(AaR)
y la toxina-1 del síndrome del shock tóxico (TSST-1).
Las toxinas citolíticas se han descrito también como hemo-
lisinas, aunque no constituye un nombre adecuado debido
a que las actividades de las cuatro primeras toxinas no se
restringen únicamente a los eritrocitos y la leucocidina P-V
es incapaz de lisar estas células. Las citotoxinas pueden
provocar la lisis de los neutrófilos, lo que da lugar a la
liberación de las enzimas lisosomales que posteriormente
dañan los tejidos circundantes. Una citotoxina, la leucoci-
dina de P-V, se ha relacionado con infecciones pulmonares
y cutáneas graves.
La toxina exfoliativa A, las enterotoxinas y la TSST-1
pertenecen a una clase de polipéptidos conocidos como
superantígenos. Estas toxinas se unen en los macrófagos a
moléculas del complejo principal de histocompatibilidad de
clase II (MHC II), las cuales interaccionan con las regiones
variables de la subunidad b de los receptores específicos
de los linfocitos T (VbTCR). Esto determina la liberación
masiva de citocinas por los macrófagos (IL-1b y factor de ne-
crosis tumoral ([TNF]) a) y los linfocitos T (IL-2, interferón g
y TNF-b). La liberación de TNF-a y TNF-b se asocia a
hipotensión y shock y la fiebre se asocia a la liberación de
IL-1b.
Citotoxinas
La toxina alfa, que puede estar codificada tanto en el cromo-
soma bacteriano como en un plásmido, es un polipéptido de
33.000 D producido por la mayoría de las cepas de S. aureus
que causan enfermedad en el ser humano. La toxina altera el
músculo liso de los vasos sanguíneos y es tóxica para muchas
células, como los eritrocitos, los leucocitos, los hepatocitos y
las plaquetas. Se integra en regiones hidrofóbicas de la mem-
brana de la célula del hospedador y forma poros de 1 a 2 nm.
CUADRO 18-2
Resumen de los estafilococos coagulasa-negativos
Biología, virulencia y enfermedades
Cocos grampositivos negativos para coagulasa y positivos
para catalasa dispuestos en racimos
Relativamente avirulentos, aunque la producción de una
capa de polisacáridos extracelulares puede facilitar
la adherencia a cuerpos extraños (catéteres, injertos,
válvulas y articulaciones protésicas, derivaciones)
y la protección frente a la fagocitosis y los antibióticos
Las infecciones incluyen endocarditis subaguda,
infecciones de cuerpos extraños e infecciones urinarias
Epidemiología
Flora humana normal de la piel y de las superficies mucosas
Los microorganismos pueden sobrevivir en las superficies
secas durante períodos de tiempo prolongados
La transmisión de persona a persona ocurre a través
del contacto directo o de la exposición a fómites
contaminados, aunque la mayor parte de las infecciones
se producen con los propios microorganismos del paciente
Los pacientes de riesgo son los que tienen cuerpos extraños
Los microorganismos son ubicuos, por lo que no hay
restricciones geográficas ni estacionales
Diagnóstico
Igual que en las infecciones por Staphylococcus aureus
Tratamiento, prevención y control
Los antibióticos de elección son la oxacilina (u otras
penicilinas resistentes a la penicilinasa) o la vancomicina
para las cepas resistentes a oxacilina
Generalmente es necesario retirar el cuerpo extraño
para que el tratamiento tenga éxito
El tratamiento precoz de la endocarditis o de las infecciones
de derivación es necesario para evitar posterior daño
tisular o la formación de inmunocomplejos
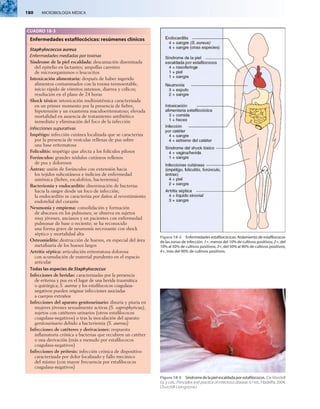
Tabla 18-3 Factores de virulencia
de Staphylococcus aureus
Factores de virulencia Efectos biológicos
Componentes estructurales
Cápsula Inhibe la quimiotaxis y la fagocitosis;
inhibe la proliferación de las células
mononucleares
Capa de limo Facilita la adherencia a los cuerpos extraños;
inhibe la fagocitosis
Peptidoglucanos Aporta estabilidad osmótica; estimula
la producción de pirógeno endógeno
(actividad similar a endotoxina); atrae
químicamente a los leucocitos (formación
de abscesos); inhibe la fagocitosis
Ácido teicoico Se une a la fibronectina
Proteína A Inhibe la eliminación mediada por
anticuerpos al ligarse a los receptores Fc
para IgG1, IgG2 e IgG4; atrae químicamente
a los leucocitos; anticomplemento
Toxinas
Citotoxinas Tóxicas para muchas células, incluidos los
leucocitos, los eritrocitos, los fibroblastos,
los macrófagos y las plaquetas
Toxinas exfoliativas
(ETA, ETB)
Proteasas de serina que rompen los puentes
intercelulares del estrato granuloso
de la epidermis
Enterotoxinas Superantígenos (estimulan la proliferación de
los linfocitos T y la liberación de citocinas);
estimulan la liberación de mediadores
de la inflamación por los mastocitos,
lo que aumenta el peristaltismo intestinal
y la pérdida de líquidos e induce náuseas
y vómitos
Toxina 1 del síndrome
del shock tóxico
Superantígeno (estimula la proliferación
de linfocitos T y la liberación de citocinas);
condiciona la fuga o destrucción celular
en las células endoteliales
Enzimas
Coagulasa Convierte el fibrinógeno en fibrina
Hialuronidasa Hidroliza los ácidos hialurónicos del tejido
conjuntivo, induciendo la diseminación
de los estafilococos por el tejido
Fibrinolisina Disuelve los coágulos de fibrina
Lipasas Hidrolizan los lípidos
Nucleasas Hidrolizan el ADN](https://image.slidesharecdn.com/murraycap18192021-220405192203/85/murray-cap-18-19-20-21-pdf-4-320.jpg)
![178 MICROBIOLOGÍA MÉDICA
El rápido flujo de salida de K+
y de entrada de Na+
, Ca2+
y
otras moléculas pequeñas conduce a aumento de volumen por
ósmosis y a lisis. Se cree que la toxina alfa es un mediador
importante del daño tisular en la enfermedad estafilocócica.
La toxina beta, conocida también como esfingomielina
sa C, es una proteína termolábil de 35.000 D producida por
la mayoría de las cepas de S. aureus que provocan enfermedad
en el ser humano y los animales. Esta enzima presenta es-
pecificidad para la esfingomielina y la lisofosfatidilcolina, y es
tóxica para diversas células, entre las que se encuentran los
eritrocitos, los fibroblastos, los leucocitos y los macrófagos.
Cataliza la hidrólisis de los fosfolípidos de la membrana en
las células susceptibles, y la lisis es proporcional a la concen-
tración de esfingomielina expuesta en la superficie celular. Se
cree que este mecanismo es responsable de las diferencias de
sensibilidad de las distintas especies a la toxina.
La toxina delta es un polipéptido de 3.000 D producido
por casi todas las cepas de S. aureus y la mayoría de las res-
tantes especies estafilocócicas (p. ej., S. epidermidis, S. hae
molyticus). La toxina tiene un amplio espectro de actividad
citolítica, afecta a los eritrocitos, muchas otras células de los
mamíferos y las estructuras de las membranas intracelulares.
Esta toxicidad de membrana relativamente inespecífica con-
cuerda con la noción que afirma que la toxina actúa como un
surfactante que altera las membranas celulares mediante una
acción de tipo detergente.
La toxina gamma (fabricada por la mayoría de las cepas de
S. aureus) y la leucocidina P-V son toxinas formadas por dos
componentes que constan de dos cadenas de polipéptidos: el
componente S (proteínas de elución lenta) y el componen
te F (proteínas de elución rápida). Se han identificado tres
proteínas S (HlgA [hemolisina gamma A], HlgC, LukS-PV)
y dos proteínas F (HlgB, LukF-PV). Las bacterias que produ-
cen ambas toxinas codifican todas estas proteínas y podrían
producir seis toxinas distintas. Estas seis toxinas pueden
lisar los neutrófilos y los macrófagos, y la actividad hemolíti-
ca más intensa se asocia a HlgA/HlgB, HlgC/HlgB y HlgA/
LukF-PV. La toxina leucocidina P-V (LukS-PV/LukF-PV) es
leucotóxica, pero carece de actividad hemolítica. La toxina leu-
cocidina P-V ha generado gran interés recientemente
porque, aunque se encuentra en menos del 5% de todas las
cepas de SARM que circulan por los hospitales, se identifica
en prácticamente todas las cepas de SARM asociadas a las
infecciones comunitarias. Esta toxina es un importante mar-
cador de identificación propio de estas cepas. La lisis celular
provocada por estas toxinas está mediada por la formación
de poros con aumento de la permeabilidad a los cationes y la
inestabilidad osmótica.
Toxinas exfoliativas
El síndrome de la piel escaldada por estafilococos (SPEE),
espectro de enfermedades que se caracteriza por la der-
matitis exfoliativa, está mediado por toxinas exfoliativas.
La prevalencia de la producción de toxina en las cepas de
S. aureus varía en función de la distribución geográfica, pero
generalmente es menor del 5%. Se han identificado dos formas
distintas de toxina exfoliativa (ETA y ETB), y ambas pueden
producir enfermedad. ETA es termoestable y el gen se asocia
con un fago, mientras que ETB es termolábil y se localiza en
un plásmido. Las toxinas son proteasas de serina que rompen
la desmogleína 1, un miembro de la familia de las estructuras
de adhesión celular (desmosomas) responsables de formar los
puentes intercelulares en el estrato granuloso de la epidermis.
Las toxinas no se asocian a procesos de citólisis ni inflama-
ción, por lo que en la capa de la epidermis afectada no están
presentes estafilococos ni leucocitos (lo cual constituye un
importante dato diagnóstico). Después de la exposición de la
epidermis a la toxina, se desarrollan anticuerpos neutralizan-
tes protectores, lo que lleva a la resolución del proceso tóxico.
El SPEE se observa fundamentalmente en niños pequeños, y
rara vez se describe en niños mayores o en adultos.
Enterotoxinas
Se ha identificado 18 enterotoxinas estafilocócicas (A a R),
de las que la enterotoxina A es la que con más frecuencia se
asocia a las intoxicaciones alimentarias. Las enterotoxinas C
y D se encuentran en los productos lácteos contaminados,
y la enterotoxina B produce colitis seudomembranosa es-
tafilocócica. La prevalencia o la importancia clínica de las res-
tantes toxinas se conocen en menor medida. Se ignora cuál es
el mecanismo exacto de acción de la toxina. Las enterotoxinas
tienen un diseño perfecto para provocar las enfermedades de
origen alimentario, ya que son estables aunque se calienten
hasta los 100 °C durante 30 minutos y resisten a la hidrólisis
por las enzimas gástricas y yeyunales. Por tanto, cuando se
contamina un producto alimentario con estafilococos pro-
ductores de enterotoxinas y se producen las toxinas, ni un
recalentado ligero de la comida ni la exposición a los ácidos
gástricos resultarán protectores. Estas toxinas se producen
en el 30-50% de las cepas de S. aureus. No se comprende
el mecanismo preciso de la actividad de las toxinas. Estas
toxinas son superantígenos capaces de inducir la activación
de los linfocitos T y la liberación de citocinas. Los cambios
histológicos característicos observados en el estómago y el
yeyuno consisten en la infiltración de neutrófilos en el epitelio
y la lámina propia subyacente, con pérdida de las células en
borde de cepillo del yeyuno. Se cree que la estimulación de
la liberación de los mediadores inflamatorios por parte de los
mastocitos origina la emesis característica de la intoxicación
alimentaria por estafilococos.
Toxina-1 del síndrome del shock tóxico
La TSST-1 es una exotoxina termoestable y resistente a la
proteólisis de 22.000 D y codificada por un gen cromosómico.
Se estima que el 90% de las cepas de S. aureus causantes
del síndrome del shock tóxico (SST) asociado a la mens-
truación y la mitad de las cepas causantes de otras formas
de SST producen TSST-1. La enterotoxina B y, rara vez, la
enterotoxina C, originan la mitad de los casos de SST no
asociados a la menstruación. La expresión in vitro de TSST-1
exige una alta concentración de oxígeno y pH neutro. A ello
podría deberse la prevalencia baja del SST comparada con las
infecciones de herida por S. aureus (una situación en la que el
ambiente de un absceso es relativamente anaerobio y ácido).
La TSST-1 es un superantígeno que estimula la liberación
de citocinas y provoca extravasación de células endoteliales,
mientras que a altas concentraciones tiene efecto citotóxico
en las células. La capacidad de la TSST-1 para atravesar las
barreras mucosas, incluso cuando la infección está localizada
en la vagina o la herida, provoca los efectos sistémicos del
SST. La muerte de las pacientes aquejadas de SST se produce
como consecuencia de un shock hipovolémico que origina
insuficiencia multiorgánica.
Enzimas estafilocócicas
Las cepas de S. aureus poseen dos formas de coagulasa:
ligada y libre. La coagulasa que se une a la pared del estafilo-
coco puede convertir directamente el fibrinógeno en fibrina
insoluble para forzar la agregación de los estafilococos. La
coagulasa libre logra el mismo resultado al reaccionar con un
factor plasmático de tipo globulina (factor de reacción con
la coagulasa) para originar una estafilotrombina, un factor](https://image.slidesharecdn.com/murraycap18192021-220405192203/85/murray-cap-18-19-20-21-pdf-5-320.jpg)







![188 © 2014. Elsevier España, S.L. Reservados todos los derechos
19
Streptococcus
1. Streptococcus pyogenes, Streptococcus agalactiae y Streptococcus pneumoniae producen
un amplio espectro de enfermedades. ¿Qué localizaciones del cuerpo humano se hallan
normalmente colonizadas por estas especies? ¿De qué modo se relaciona este hecho con
las infecciones causadas por estas bacterias?
2. Los estreptococos viridans (es decir, los estreptococos a-hemolíticos y no hemolíticos)
se subdividen en cinco grupos. ¿Cuáles son los grupos y las enfermedades específicas asociadas
con cada uno de los grupos?
Las respuestas a estas preguntas están disponibles en www.StudentConsult.es
El género Streptococcus es un grupo formado por diversos
cocos grampositivos que normalmente se disponen en pa-
rejas o en cadenas (a diferencia de los racimos formados por
Staphylococcus). La mayoría de las especies son anaerobios
facultativos, y algunos crecen únicamente en una atmósfera
enriquecida con dióxido de carbono (crecimiento capnofí-
lico). Sus exigencias nutricionales son complejas, y su ais-
lamiento requiere el uso de medios enriquecidos con sangre
o suero. Son capaces de fermentar carbohidratos, proceso que
produce ácido láctico, y son catalasa-negativos, a diferencia
de las especies del género Staphylococcus.
Un gran número de especies estreptocócicas destaca por
su papel como patógenos humanos, los más frecuentes de
los cuales se describen en este capítulo (tabla 19-1). Lamen-
tablemente, la clasificación de las especies que componen
este género es complicada debido a que se utilizan tres sis-
temas diferentes parcialmente coincidentes: 1) propiedades
serológicas: grupos de Lancefield (originalmente, A a W);
2) patrones hemolíticos: hemólisis completa (beta [b]),
hemólisis incompleta (alfa [a]) y ausencia de hemólisis
(gamma [g]), y 3) propiedades bioquímicas (fisiológicas).
Aunque constituye una simplificación en exceso, es prácti-
co pensar que los estreptococos se dividen en dos grupos:
1) los estreptococos b-hemolíticos, que se clasifican según los
grupos de Lancefield, y 2) los estreptococos a-hemolíticos
y g-hemolíticos, que se clasifican por pruebas bioquímicas.
Este último grupo se denomina colectivamente estreptococos
viridans, nombre derivado de viridis (en latín, «verde»), que
hace referencia al pigmento verde formado por la hemólisis
parcial en el agar sangre.
Rebecca Lancefield desarrolló en 1933 el sistema de cla-
sificación serológica para diferenciar las cepas b-hemolíticas.
La mayoría de estas cepas y algunas de las a-hemolíticas y no
hemolíticas poseen antígenos específicos de grupo, la mayoría
de los cuales son carbohidratos. Estos antígenos se pueden
detectar fácilmente con pruebas inmunológicas y han sido
útiles para la identificación rápida de algunos patógenos es-
treptocócicos. Por ejemplo, una enfermedad causada por
Streptococcus pyogenes (clasificado como Streptococcus de gru
po A en el sistema de Lancefield) causa faringitis estreptocó-
cica. El antígeno de grupo de este microorganismo se puede
detectar en los exudados faríngeos mediante una variedad de
inmunoensayos comerciales rápidos y es una prueba diagnós-
tica utilizada comúnmente en los laboratorios del hospital
y en las consultas. El sistema de Lancefield se restringe
en la actualidad a un número reducido de especies de es-
treptococos (los pertenecientes a los grupos A, B, C, F y G;
tabla 19-2). Los estreptococos viridans se subdividen en cinco
grupos clínicamente distintos (tabla 19-3). Algunas especies de
los estreptococos viridans pueden ser b-hemolíticos así como
a-hemolíticos y no hemolíticos, lo que lamentablemente ha
dado lugar a que estas bacterias se clasifiquen según los grupos
de Lancefield y como estreptococos viridans. Aunque la cla-
sificación de los estreptococos es algo confuso, la enfermedad
clínica está bien definida en relación con las especies indivi-
duales, lo que formará el énfasis en lo que resta del capítulo.
Streptococcus pyogenes (cuadro 19-1)
S. pyogenes origina diversas enfermedades supurativas y no
supurativas (cuadro 19-2). Aunque este microorganismo
constituye la causa más frecuente de faringitis bacteriana,
la fama de estos microorganismos, denominados bacterias
necrosantes, se debe a la mionecrosis grave que provocan.
Fisiología y estructura
Las cepas de S. pyogenes son cocos esféricos de diámetro com-
prendido entre 1 y 2 mm que forman cadenas cortas en las
muestras clínicas y cadenas de mayor longitud cuando crecen
en medios de cultivo (fig. 19-1). Su crecimiento es óptimo en
el medio de agar sangre enriquecido, pero se inhibe cuando
contiene una concentración elevada de glucosa. Después
de 24 horas de incubación se observan colonias blancas de
1 a 2 mm con grandes zonas de b-hemólisis (fig. 19-2).
Se ha estudiado detalladamente la estructura antigénica
de S. pyogenes. El marco estructural básico de la pared celular
es la capa de peptidoglucano, la cual tiene una composición
parecida a la de otras bacterias grampositivas. En el interior de
la pared celular se encuentran los antígenos específicos
de grupo y de tipo. El carbohidrato específico de grupo,
el cual constituye aproximadamente el 10% del peso seco
de la célula (antígeno del grupo A de Lancefield), es un
dímero de N-acetilglucosamina y de ramosa. Este antígeno
se usa para clasificar a los estreptococos del grupo A y dis-
tinguirlos de otros grupos de estreptococos. La proteína M
es la principal proteína específica de tipo que se asocia a
los estreptococos virulentos. Se compone de dos cadenas
polipeptídicas que forman una hélice alfa. La proteína se ancla](https://image.slidesharecdn.com/murraycap18192021-220405192203/85/murray-cap-18-19-20-21-pdf-16-320.jpg)
![Streptococcus 189
©
Elsevier.
Fotocopiar
sin
autorización
es
un
delito.
a la membrana citoplásmica, se extiende a través de la pared
celular y sobresale por encima de la superficie celular. El
extremo carboxilo, que está anclado en la membrana citoplás-
mica, y la porción de la molécula incluida en la pared celular
están muy conservadas (por secuencia de aminoácidos) en
todos los estreptococos del grupo A. El extremo amino, que
se extiende sobre la superficie celular, origina las diferencias
antigénicas observadas entre los más de cien serotipos de
proteínas M. Las proteínas M se subdividen en moléculas
de clase I y de clase II. Las proteínas M de clase I comparten
los antígenos expuestos, mientras que las proteínas M de
clase II carecen de antígenos expuestos comunes. A pesar
de que las cepas portadoras de ambas clases de antígenos
pueden provocar infecciones supurativas y glomerulonefritis,
tan sólo las bacterias que contienen proteínas M de clase I
(antígenos expuestos comunes) producen fiebre reumática. La
clasificación epidemiológica de S. pyogenes se basa en el análisis
de las secuencias del gen emm que codifica las proteínas M.
Otros componentes importantes de la pared celular de
S. pyogenes son las proteínas de tipo M, el ácido lipoteicoico
y la proteína F. Las proteínas de tipo M están codificadas por
un complejo de más de 20 genes que componen la superfa-
milia de genes emm. Estos genes codifican las proteínas M,
las proteínas de tipo M y otras proteínas que se unen a las in-
munoglobulinas (Ig). El ácido lipoteicoico y la proteína F
facilitan la unión a las células del hospedador, al formar un
complejo con la fibronectina que se encuentra presente en la
superficie de las células del hospedador.
Algunas cepas de S. pyogenes tienen una cápsula externa
de ácido hialurónico, que no se diferencia a nivel antigénico
del ácido hialurónico presente en los tejidos conjuntivos de
mamífero. Dado que la cápsula puede proteger a la bacteria
de la fagocitosis, las cepas encapsuladas son las responsables
más probables de las infecciones sistémicas graves.
Patogenia e inmunidad
La virulencia de los estreptococos del grupo A está de
terminada por la capacidad de las bacterias de adherirse a
la superficie de las células del hospedador, invadir las células
epiteliales y producir una variedad de toxinas y de enzimas.
Interacciones hospedador-parásito iniciales
S. pyogenes dispone, además, de otros mecanismos para
evitar la opsonización y la fagocitosis. La cápsula de ácido
hialurónico es poco inmunogénica e interfiere con la fagoci-
tosis. Las proteínas M interfieren también con la fagocitosis
al bloquear la unión del componente C3b del complemento,
un mediador importante en la fagocitosis. C3b puede ser
degradado también por el factor H que se une a la superficie
celular de la proteína M. Las proteínas de tipo M se asemejan
a ella en su estructura y se hallan bajo el mismo control regu-
lador. Estas proteínas interfieren en la fagocitosis al unirse ya
sea al fragmento Fc de los anticuerpos o a la fibronectina, que
bloquea la activación del complemento por la ruta alternativa
y reduce la cantidad de C3b unido. Por último, todas las
cepas de S. pyogenes tienen en la superficie una peptidasa de
C5a. Esta serina proteasa inactiva C5a, molécula quimioa-
trayente de neutrófilos y fagocitos mononucleares, y protege
la bacteria de una depuración precoz de los tejidos infectados.
Tabla 19-2 Clasificación de estreptococos
b-hemolíticos comunes
Grupo
Especie
representativa Enfermedades
A S. pyogenes Faringitis, infecciones de la piel y los
tejidos blandos, bacteriemia, fiebre
reumática, glomerulonefritis aguda
grupo S. anginosus Abscesos
B S. agalactiae Enfermedad neonatal, endometritis,
infecciones de heridas, infecciones
del tracto urinario, bacteriemia,
neumonía, infecciones de la piel y
de los tejidos blandos
C S. dysgalactiae Faringitis, glomerulonefritis aguda
F, G grupo S. anginosus Abscesos
S. dysgalactiae Faringitis, glomerulonefritis aguda
Tabla 19-3 Clasificación del grupo viridans
de Streptococcus
Grupo
Especies
representativas Enfermedades
Anginosus S. anginosus,
S. constellatus,
S. intermedius
Abscesos cerebrales,
orofaríngeos y en la
cavidad peritoneal
Mitis S. mitis,
S. pneumoniae,
S. oralis
Endocarditis subaguda,
sepsis en pacientes
neutropénicos, neumonía,
meningitis
Mutans S. mutans, S. sobrinus Caries dental, bacteriemia
Salivarius S. salivarius Bacteriemia, endocarditis
Bovis S. gallolyticus
subespecie
gallolyticus,
subespecie
pasteurianus
Bacteriemia asociada
a cáncer digestivo
(subespecie gallolyticus);
meningitis (subespecie
pasteurianus)
No agrupados S. suis Meningitis, bacteriemia,
síndrome del shock tóxico
estreptocócico
Tabla 19-1 Estreptococos importantes
Microorganismo Origen histórico
Streptococcus streptus, flexible; coccus, grano o baya (un grano
o baya flexible; en referencia al aspecto de las
largas y flexibles cadenas de cocos)
S. agalactiae agalactia, necesidad de leche (la cepa inicial
[bautizada como S. mastitidis] originaba mastitis
bovina)
S. anginosus anginosus, relativo a la angina
S. constellatus constellatus, tachonado de estrellas (la cepa
aislada inicialmente se encontraba inmersa
en agar y la colonia de mayor tamaño estaba
rodeada de otras colonias más pequeñas; la
formación en satélite no tiene lugar alrededor
de las colonias situadas sobre la superficie de
una placa de agar)
S. dysgalactiae dys, enfermo, duro; galactia, relativo a la leche
(pérdida de la secreción de leche; las cepas
causaban mastitis bovina)
S. gallolyticus gallatum, galato; lyticus, aflojar (capaz de
hidrolizar o digerir el metil galato)
S. intermedius intermedius, intermedio (confusión inicial acerca de
si se trataba de una bacteria aerobia o anaerobia)
S. mitis mitis, leve (se pensó, erróneamente, que producía
infecciones leves)
S. mutans mutans, cambiante (cocos que pueden adoptar
un aspecto bacilar, en especial cuando se aíslan
inicialmente en un cultivo)
S. pneumoniae pneumon, los pulmones (causa neumonía)
S. pyogenes pyus, pus; gennaio, engendrar o producir
(productor de pus; se asocia habitualmente a la
formación de pus en heridas)
S. salivarius salivarius, salivar (se detecta en la saliva de la boca)](https://image.slidesharecdn.com/murraycap18192021-220405192203/85/murray-cap-18-19-20-21-pdf-17-320.jpg)


![192 MICROBIOLOGÍA MÉDICA
lisosómicos después de ser englobada por este orgánulo y
provoca la subsiguiente destrucción de la célula fagocítica.
La estreptolisina S se produce en presencia de suero (la S
indica estable en suero) y es la responsable de la b-hemólisis
característica que se observa en el medio de agar sangre.
La estreptolisina O es una hemolisina lábil al oxígeno capaz
de lisar eritrocitos, leucocitos, plaquetas y células en cultivo.
Esta hemolisina guarda relación antigénica con las toxinas
lábiles al oxígeno que producen Streptococcus pneumoniae,
Clostridium tetani, Clostridium perfringens, Bacillus cereus y
Listeria monocytogenes. Se forman anticuerpos con facilidad
frente a la estreptolisina O (anticuerpos anti-estreptolisina O
[ASLO]), una característica que los distingue de la estreptoli-
sina S, y sirven para demostrar una infección reciente por es-
treptococos del grupo A (prueba ASLO). La estreptolisina O
se inhibe de forma irreversible por el colesterol de los lípidos
cutáneos, de forma que los pacientes con infecciones cutáneas
no desarrollan anticuerpos frente a ASLO.
Al menos se han descrito dos formas de estreptocina
sa (A y B). Estas enzimas intervienen en la degradación
del plasminógeno, con la consiguiente liberación de la pro-
teína plasmina, que a su vez se encarga de la degradación de la
fibrina y el fibrinógeno. Por tanto, estas enzimas pueden lisar
los coágulos de sangre y los depósitos de fibrina y facilitar la
rápida diseminación de S. pyogenes por los tejidos infectados.
Los anticuerpos frente a estas enzimas (anticuerpos frente a
estreptocinasa) son un marcador útil de infección.
Se han descrito cuatro desoxirribonucleasas distintas a
nivel inmunológico (ADNasas A-D). Estas enzimas no son
citolíticas, pero pueden despolimerizar el ácido desoxirribo-
nucleico (ADN) existente en el pus. Este proceso reduce la
viscosidad del material del absceso y facilita la diseminación
de los microorganismos. Los anticuerpos desarrollados frente
a la ADNasa B son un marcador importante de las infeccio-
nes por S. pyogenes (prueba anti-ADNasa B), sobre todo
en pacientes con infecciones cutáneas porque no elaboran
anticuerpos frente a la estreptolisina O (v. texto anterior).
Epidemiología
Los Centros para el Control y la Prevención de Enfermeda-
des (CDC) estimaron que en el año 2010 se registraron más
de 5.000 casos de enfermedad invasiva por S. pyogenes en
EE.UU. Se observaron 142 casos de síndrome de shock tó-
xico estreptocócico. Se produjeron, al menos, 10 millones de
casos de enfermedad no invasiva, y la faringitis y el pioderma
fueron las infecciones más frecuentes. Los estreptococos del
grupo A colonizan normalmente la bucofaringe de niños sanos
y adultos jóvenes. Sin embargo, el aislamiento de S. pyogenes
en un paciente con faringitis se considera en general signi-
ficativo. La colonización asintomática por S. pyogenes suele
ser transitoria, viene regulada por la capacidad del paciente
de orquestar una respuesta inmunitaria específica frente a
la proteína M de la cepa colonizadora y la presencia de mi-
croorganismos competitivos en la orofaringe. Los pacientes
no tratados producen anticuerpos frente a la proteína M es-
pecífica de la bacteria, lo que puede determinar inmunidad
de por vida; sin embargo, esta respuesta de anticuerpos se
reduce en los pacientes tratados.
En general, la enfermedad por S. pyogenes se debe a cepas
de adquisición reciente que causan infección de la faringe o
la piel antes de que se produzcan anticuerpos específicos
o de que los microorganismos competidores sean capaces de
proliferar. La faringitis producida por S. pyogenes representa
una enfermedad que afecta fundamentalmente a niños de
edades comprendidas entre 5 y 15 años, aunque los lactantes
y los adultos también son vulnerables a esta entidad. El pa-
tógeno se transmite de una persona a otra a través de gotitas
respiratorias. El hacinamiento, como en el caso de las aulas y
las guarderías, incrementa la posibilidad de diseminación del
microorganismo, en especial durante los meses de invierno.
Las infecciones de tejidos blandos (p. ej., pioderma, erisipela,
celulitis, fascitis) se ven precedidas generalmente de una
colonización inicial de la piel por estreptococos del grupo A,
después de la cual los microorganismos se introducen en los
tejidos superficiales o profundos a través de una alteración
de la barrera que constituye la piel.
Enfermedades clínicas
Enfermedades estreptocócicas supurativas
Faringitis
La faringitis se desarrolla generalmente entre 2 y 4 días des-
pués de la exposición al patógeno, con el inicio brusco de do-
lor de garganta, fiebre, malestar general y cefalea. La faringe
posterior puede tener un aspecto eritematoso con presencia
de exudado, y puede existir una acusada linfadenopatía cervi-
cal. A pesar de estos síntomas y signos clínicos, resulta difícil
distinguir la faringitis estreptocócica de la faringitis vírica.
El diagnóstico de certeza sólo se puede conseguir mediante
pruebas de laboratorio específicas.
La escarlatina es una complicación de la faringitis estrep-
tocócica que tiene lugar cuando la cepa infecciosa es lisogeni-
zada por un bacteriófago que media en la producción de una
exotoxina pirógena. Aparece un exantema eritematoso difuso,
inicialmente en la parte superior del tórax para luego extenderse
a las extremidades en un plazo de 1 o 2 días desde el inicio de
los síntomas clínicos de faringitis. Generalmente respeta la zona
peribucal (palidez peribucal), así como las palmas y las plantas.
La lengua está cubierta en un primer momento de un exudado
blanco amarillento, posteriormente se descama y revela una
superficie roja y denudada («lengua aframbuesada»). El exan-
tema, el cual palidece con la presión, se observa mejor en el ab-
domen y los pliegues cutáneos (líneas de Pastia). El exantema
desaparece a lo largo de los 5 o 7 días siguientes y es sustituido
por una descamación de la capa cutánea superficial. Desde la
introducción del tratamiento antimicrobiano son infrecuentes
las complicaciones supurativas de la faringitis estreptocócica
(como los abscesos periamigdalinos y retrofaríngeos).
Pioderma
El pioderma (impétigo) es una infección localizada y purulen-
ta («pio») de la piel («derma») que afecta fundamentalmente
las zonas expuestas (p. ej., cara, brazos, piernas). La infección
comienza cuando la piel se coloniza por S. pyogenes tras un
contacto directo con una persona o fómites infectados. Pos-
teriormente el microorganismo se introduce en los tejidos
subcutáneos a través de alguna interrupción de la barrera
que supone la piel (p. ej., arañazo, picadura de insecto). Se
forman vesículas que más tarde se transforman en pústulas
(vesículas llenas de pus) para después romperse y producir
costras. Los ganglios linfáticos regionales pueden encontrarse
hipertrofiados, pero son infrecuentes los signos de infección
sistémica (p. ej., fiebre, septicemia, afectación de otros órga-
nos). Es típica la diseminación dérmica de la infección como
consecuencia del rascado.
El pioderma se observa fundamentalmente en niños pe-
queños con malas condiciones de higiene personal, y suele
registrarse durante los meses cálidos y húmedos. Aunque
S. pyogenes es el agente etiológico de la mayor parte de
las infecciones estreptocócicas cutáneas, también pueden](https://image.slidesharecdn.com/murraycap18192021-220405192203/85/murray-cap-18-19-20-21-pdf-20-320.jpg)






![Streptococcus 201
©
Elsevier.
Fotocopiar
sin
autorización
es
un
delito.
está unido a la capa de peptidoglucano y se extiende a través
de la cápsula que la rodea. Esta estructura específica de es-
pecie, llamada polisacárido C, no tiene relación alguna con los
carbohidratos específicos de grupo que describió Lancefield en
los estreptococos b-hemolíticos. El polisacárido C precipita una
fracción de las globulinas séricas (proteína C reactiva [CRP])
en presencia de calcio. La CRP está presente en bajas concen-
traciones en personas sanas, pero aparece a concentraciones
elevadas en pacientes con enfermedades inflamatorias agudas
(por eso se emplea el seguimiento de las concentraciones de
CRP para predecir la inflamación). El ácido teicoico unido
a los lípidos en la membrana citoplásmica bacteriana recibe
el nombre de antígeno F debido a su capacidad de producir
reacción cruzada con los antígenos de superficie de Forssman
de las células de mamífero. Ambas formas del ácido teicoico se
asocian a residuos de fosforilcolina. La fosforilcolina es única
de la pared celular de S. pneumoniae y desempeña un papel
regulador importante en la hidrólisis de la misma. Debe existir
fosforilcolina para que la autolisina neumocócica amidasa esté
activa durante la división celular.
Patogenia e inmunidad
Aunque S. pneumoniae se ha estudiado a fondo, aún queda
mucho por saber sobre la patogenia de la enfermedad neu-
mocócica. Las manifestaciones de la enfermedad se deben
fundamentalmente a la respuesta del hospedador frente a la
infección en mayor medida que a la producción de factores
tóxicos específicos del microorganismo. Sin embargo, resulta
crucial comprender el modo de colonización de la bucofaringe
por S. pneumoniae, su diseminación a tejidos normalmente es-
tériles, la estimulación de una respuesta inflamatoria local y los
mecanismos para evitar ser destruido por las células fagocíticas.
Colonización y migración
S. pneumoniae es un patógeno humano que coloniza la buco-
faringe, y en situaciones específicas es capaz de diseminarse
a los pulmones, los senos paranasales y el oído medio. Tam-
bién puede ser transportado a través de la sangre a regiones
tan distales como el cerebro. La colonización inicial de la
bucofaringe está mediada por la unión de las bacterias a las
células epiteliales por medio de adhesinas de superficie.
La migración posterior del microorganismo a las vías res-
piratorias inferiores se puede impedir cuando las bacterias
están rodeadas de mucosidad y son eliminadas del aparato
respiratorio mediante la acción de las células del epitelio
ciliado. Las bacterias neutralizan este envoltorio a través
de la producción de una proteasa de IgA secretora y una
neumolisina. La IgA secretora atrapa a las bacterias en el
moco al unirlas a la mucina con la región Fc del anticuerpo.
La proteasa IgA bacteriana evita esta interacción. La neu-
molisina, una citotoxina semejante a la estreptolisina O de
S. pyogenes, se une al colesterol de las membranas celulares del
hospedador y crea poros. Esta actividad puede destruir tanto
a las células del epitelio ciliado como a las células fagocíticas.
Destrucción tisular
Una característica de las infecciones neumocócicas es la movili-
zación de las células inflamatorias hacia el foco de la infección.
El proceso está mediado por el ácido teicoico neumocócico,
fragmentos de peptidoglucano y neumolisina. El ácido teicoico
y los fragmentos de peptidoglucano activan la ruta alternativa
del complemento, produciendo C5a, el cual interviene en
el proceso inflamatorio. Esta actividad se ve potenciada por
la amidasa bacteriana, la cual favorece la liberación de los
componentes de la pared celular. La neumolisina activa la ruta
clásica del complemento, dando lugar a la producción de los
componentes C3a y C5a. Como consecuencia de lo anterior,
los leucocitos activados fabrican citocinas como la interleuci-
na 1 (IL-1) y el factor de necrosis tumoral a (TNF-a), lo que
provoca la migración de las células inflamatorias a las zonas de
infección, fiebre, daño tisular y otros signos característicos
de la infección estreptocócica. La producción de peróxido de
hidrógeno por S. pneumoniae puede ocasionar, igualmente, daño
tisular causado por los intermediarios reactivos del oxígeno.
Por último, la fosforilcolina de la pared de la célula bac-
teriana se puede unir a los receptores del factor activador
de plaquetas que se expresan en la superficie de las células
endoteliales, los leucocitos, las plaquetas y algunas células de
tejidos como los pulmones y las meninges. Mediante su unión
a estos receptores, las bacterias logran entrar en las células,
donde se encuentran protegidas de la opsonización y la fago-
citosis, y desde ellas se diseminan a zonas restringidas, como
la sangre y el sistema nervioso central. Esta actividad facilita la
diseminación de la enfermedad.
Supervivencia fagocítica
S. pneumoniae sobrevive a la fagocitosis como consecuen-
cia de la protección antifagocítica que le proporcionan su
cápsula y la inhibición de la actividad oxidativa fagocítica
de la célula mediada por neumolisina, la cual es necesaria
para producir la destrucción intracelular. La virulencia de
S. pneumoniae representa una consecuencia directa de la
presencia de dicha cápsula. Las cepas encapsuladas (lisas)
pueden producir enfermedad en el ser humano y en anima-
les de experimentación, mientras que las cepas carentes de
cápsula (rugosas) no son virulentas. Los anticuerpos dirigi-
dos frente a los polisacáridos capsulares específicos de tipo
confieren protección frente a la enfermedad provocada por
cepas inmunológicamente relacionadas. Los polisacáridos
capsulares son solubles y se conocen como sustancias solu-
bles específicas. Los polisacáridos libres pueden proteger a
los microorganismos viables de la fagocitosis al unirse con los
anticuerpos opsonizantes.
Epidemiología
S. pneumoniae habita con frecuencia en la faringe y la nasofa-
ringe de personas sanas. La colonización es más frecuente en
niños que en adultos, y es habitual en adultos que conviven
con niños. La colonización tiene lugar inicialmente alrededor
de los 6 meses de edad. Posteriormente, el niño es colonizado de
manera transitoria por otros serotipos del microorganismo. La
duración del estado de portador disminuye con cada serotipo
sucesivo que coloniza, en parte debido al desarrollo de inmu-
nidad específica de serotipo. Aunque los nuevos serotipos se
adquieren a lo largo de todo el año, la incidencia de portadores
y de enfermedad asociada es más elevada durante los meses
fríos. Las cepas neumocócicas capaces de producir enfermedad
son las mismas que se asocian al estado de portador.
La enfermedad neumocócica aparece cuando los microor-
ganismos que colonizan la nasofaringe y la bucofaringe se
diseminan hasta localizaciones alejadas, como los pulmones
(neumonía), los senos paranasales (sinusitis), los oídos (otitis
media) y las meninges (meningitis). En todas estas enferme-
dades se puede producir una diseminación hematógena de
S. pneumoniae hacia otros lugares.
Aunque la introducción de vacunas para los niños y adul-
tos ha reducido la incidencia de la enfermedad causada por
S. pneumoniae, este microorganismo sigue siendo una causa
frecuente de neumonía bacteriana, meningitis, otitis media
y sinusitis y bacteriemia extrahospitalarias. La incidencia de](https://image.slidesharecdn.com/murraycap18192021-220405192203/85/murray-cap-18-19-20-21-pdf-29-320.jpg)










![212 MICROBIOLOGÍA MÉDICA
cuadro evoluciona con rapidez a una enfermedad sistémi-
ca. La mortalidad asociada al carbunco digestivo se acerca
al 100%.
A diferencia de lo que ocurre con las otras dos formas de
carbunco, el carbunco por inhalación se puede asociar a un
período prolongado de latencia (2 meses o más) durante el
cual la persona infectada permanece asintomática. Las es-
poras pueden permanecer en estado de latencia en las fosas
nasales o bien alcanzar las vías respiratorias inferiores, donde
los macrófagos alveolares ingieren las esporas inhaladas y
las transportan a los ganglios linfáticos mediastínicos. Los
síntomas clínicos iniciales de la entidad son inespecíficos:
fiebre, mialgias, tos no productiva y malestar. La segunda fase
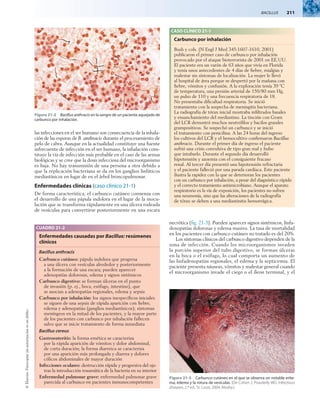
de la enfermedad es más espectacular, con un empeoramiento
rápido de la fiebre y el edema, y adenopatía mediastínica (la
cual origina el ensanchamiento mediastínico que se observa
en la radiografía de tórax; fig. 21-4). A pesar de que la vía de
infección corresponde a la inhalación, rara vez se desarrolla
enfermedad pulmonar. En un 50% de los sujetos que han
contraído la entidad por inhalación se aprecian signos me-
níngeos. Casi todos los casos evolucionan a shock y muerte a
lo largo de los 3 días siguientes al comienzo de los síntomas
a no ser que exista sospecha de carbunco y se instaure un
tratamiento de forma inmediata. Las pruebas serológicas
indican que no existe una forma de carbunco por inhalación
subclínica o asintomática. Casi todos los pacientes que su-
fren la enfermedad fallecen salvo que se apliquen de forma
inmediata medidas médicas.
Diagnóstico de laboratorio
Las infecciones por B. anthracis se caracterizan por la pre-
sencia de elevadísimas concentraciones de microorganismos
en las heridas, los ganglios linfáticos afectados y la sangre.
El carbunco es una de las pocas enfermedades bacterianas
en la que se reconocen los microorganismos en una tinción
con Gram de un frotis de sangre periférica (v. fig. 21-2). Por
consiguiente, la detección de las bacterias en la microscopia y
los cultivos no supone ningún problema. La dificultad diagnós-
tica radica en la distinción de B. anthracis de otros miem-
bros taxonómicamente cercanos del grupo de B. cereus. La
identificación preliminar de B. anthracis se basa en las mor-
fologías de sus células al microscopio y de sus colonias. Los
microorganismos aparecen en forma de bacilos grampositivos
delgados y largos que se disponen de forma independiente o
formando cadenas de gran longitud. Las esporas no aparecen
en las muestras clínicas, sino tan sólo en cultivos incubados en
atmósfera pobre en dióxido de carbono (CO2) y se visualizan
con mayor facilidad al aplicar una tinción especial para estas
estructuras (como verde malaquita; fig. 21-5). La cápsula
de B. anthracis se produce in vivo, pero típicamente no se
observa en cultivo. La cápsula se observa por medio de una
tinción de contraste, como la tinta china (la cápsula rechaza
las partículas de tinta, de modo que el trasfondo, pero no el
área que rodea a las bacterias, presenta una tonalidad oscura),
la tinción de azul de metileno (reacción de M9Fadyean) o una
prueba con un anticuerpo fluorescente directo (DFA) frente
al polipéptido capsular. Las colonias cultivadas en agar sangre
de carnero son de gran tamaño, carecen de pigmentación y
presentan una superficie seca de «cristal molido» y bordes
irregulares con proyecciones a lo largo de las estrías de ino-
culación de la muestra en la placa (lo que se conoce como
morfología de «la cabeza de Medusa»). Las colonias son relati-
vamente pegajosas y se adhieren al agar cuyo borde se parece
a la clara de huevo montada cuando se separa de la placa con
un asa de siembra. A diferencia de B. cereus, las colonias no
son hemolíticas; B. anthracis no son móviles en las pruebas de
movilidad, como la observación de bacilos aislados en una gota
suspendida del medio de cultivo. La identificación definitiva
de microorganismos inmóviles no hemolíticos semejantes a
B. anthracis se efectúa en un laboratorio de referencia median-
te la demostración de la producción de cápsula (microscopia
o DFA) y lisis de la bacteria con un fago gamma o resultados
positivos en una prueba de DFA frente a un polisacárido es-
pecífico de la pared celular de B. anthracis. Asimismo, se han
puesto a punto pruebas de amplificación de ácidos nucleicos
(p. ej., reacción en cadena de la polimerasa [PCR]), las cuales
se llevan a cabo en laboratorios de referencia. Se dispone de
equipos comerciales de PCR.
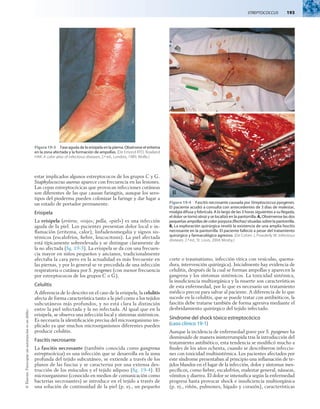
Figura 21-4 Carbunco por inhalación en el que se aprecia la presencia
de adenopatía mediastínica (puntas de flecha).
Figura 21-5 Bacillus cereus. Las esporas retienen el colorante verde de
malaquita en esta tinción especial para esporas, y las células vegetativas
se muestran en color gris o incoloras.](https://image.slidesharecdn.com/murraycap18192021-220405192203/85/murray-cap-18-19-20-21-pdf-42-320.jpg)



