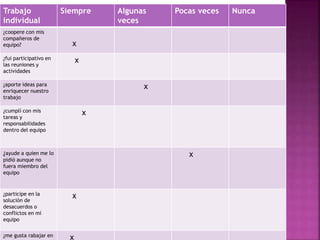
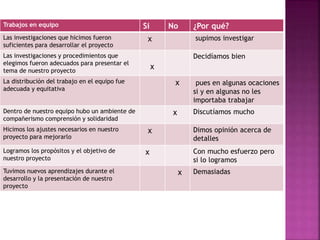
El documento presenta información sobre diferentes temas relacionados con la química y la tecnología, incluyendo: 1) El uso de películas nanoestructuradas para proteger turbinas de aviones de altas temperaturas, 2) Una ventana solar que genera energía, 3) El debate sobre las energías alternativas, 4) La cantidad de acero que se disuelve a nivel mundial debido a la corrosión, y 5) Diferentes métodos para prevenir la corrosión como la protección catódica y el uso de ánodos de sacrificio.