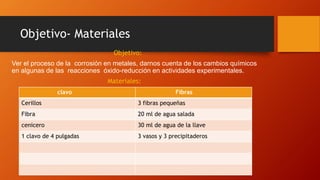
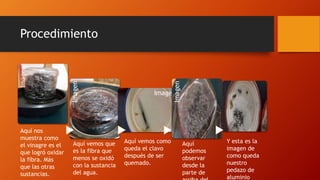
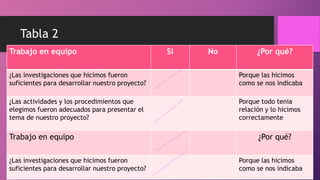
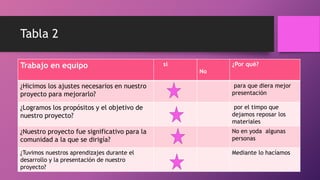
El documento habla sobre la corrosión. Define la corrosión como el deterioro de un material debido a un ataque electroquímico. Explica que la corrosión involucra tres factores: la pieza manufacturada, el ambiente o agua, y una reacción electroquímica. Además, menciona que cada segundo se disuelven 5 toneladas de acero en el mundo debido a la corrosión.