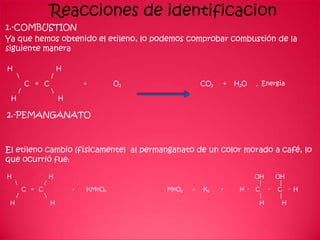
Este documento describe un experimento para producir etileno calentando alcohol etílico y ácido sulfúrico concentrado. Se realizaron varias pruebas como combustión, reacción con permanganato y adición de bromo para identificar el etileno producido. El proceso de deshidratación regenera el ácido sulfúrico y produce etileno y agua como productos.