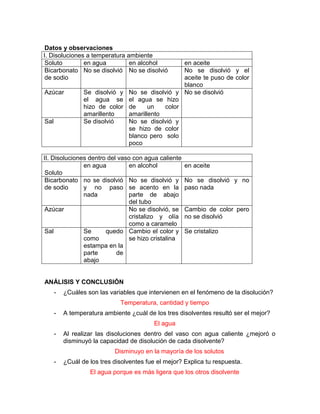
El documento describe un experimento para determinar la capacidad de disolución del agua, etanol y aceite mineral. Los estudiantes disolvieron sal, azúcar y bicarbonato de sodio en cada disolvente a temperatura ambiente y caliente, observando que el agua fue el mejor disolvente a temperatura ambiente mientras que la capacidad de disolución generalmente disminuyó al calentar.