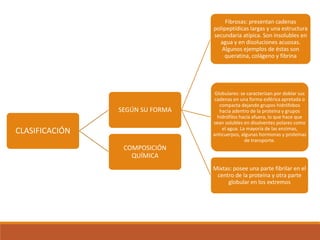
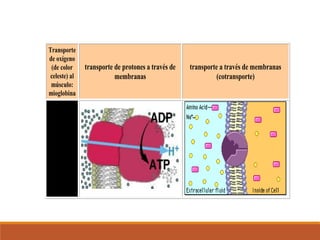
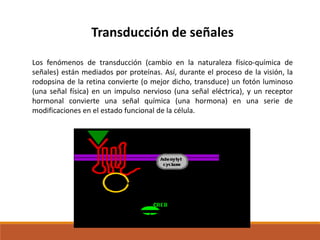
El documento describe las proteínas, macromoléculas formadas por cadenas de aminoácidos que cumplen funciones esenciales para la vida. Se clasifican según su forma, solubilidad y composición. Desempeñan funciones como catalizadoras enzimáticas, de transporte, estructurales, de defensa, movimiento y reserva de nutrientes. Son indispensables para los procesos metabólicos y la regulación celular.