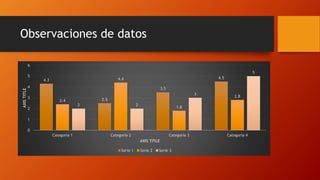
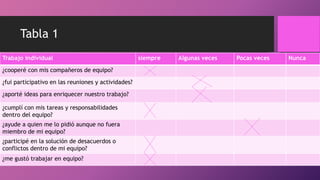
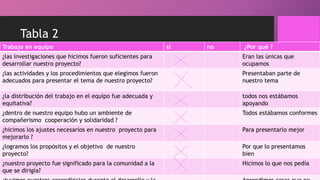
La bicicleta se oxidó debido a que se mojó y se dejó expuesta a la lluvia. Al exponerse los metales como el hierro al agua y el oxígeno del aire, se produjeron reacciones de oxidación-reducción (redox) que causaron manchas marrones en la bicicleta y que la cadena se atorara.