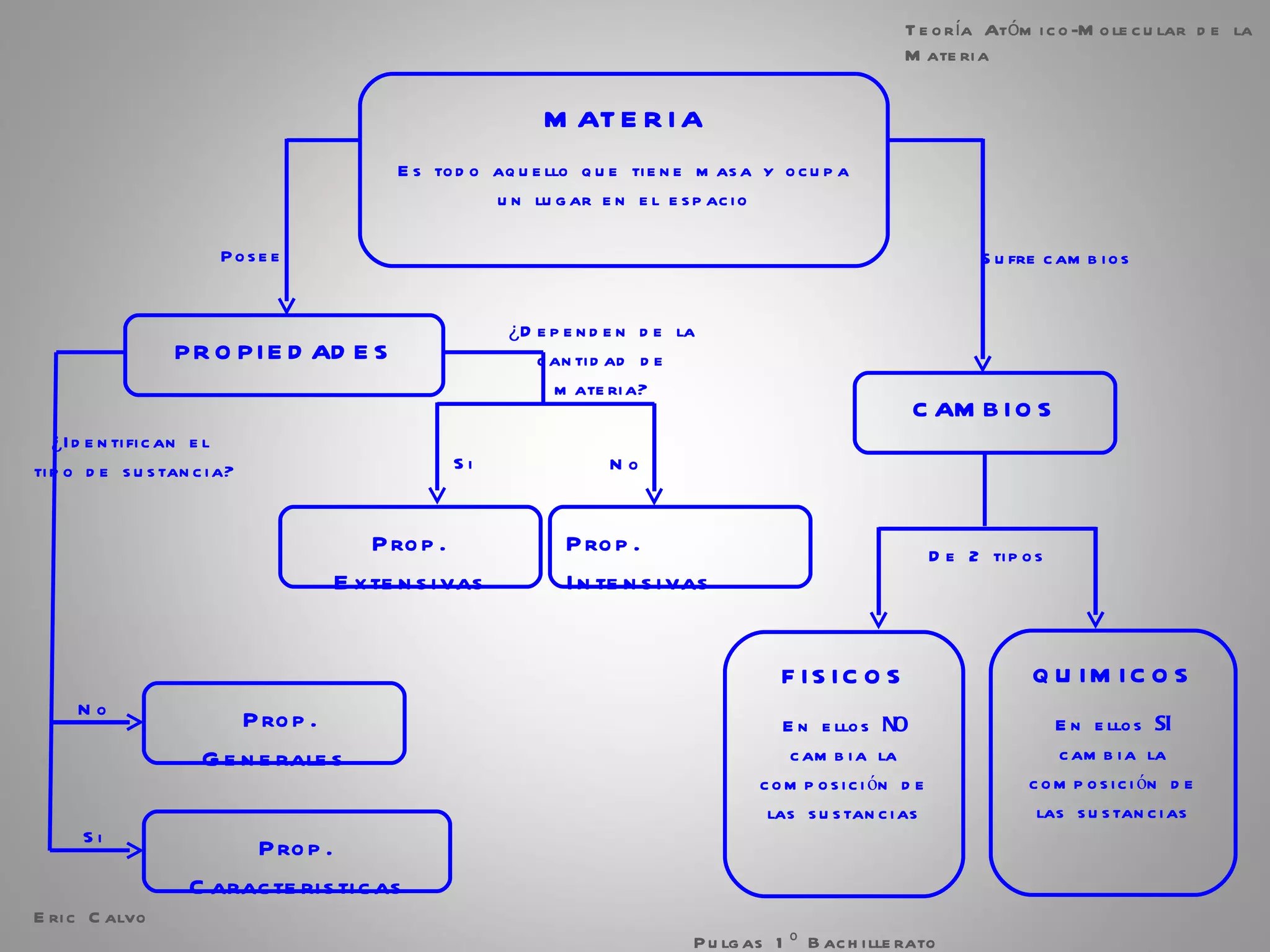
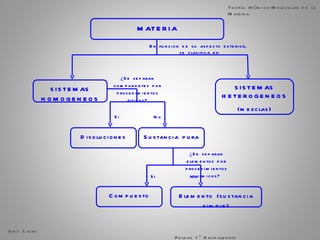
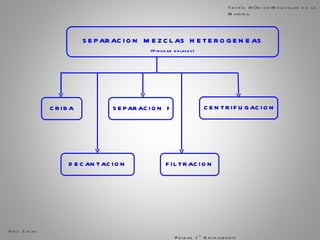
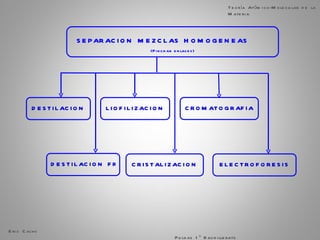
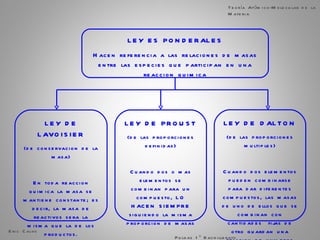
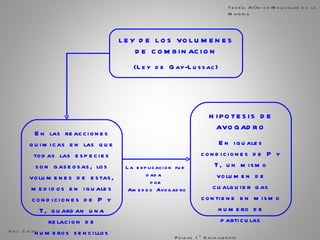
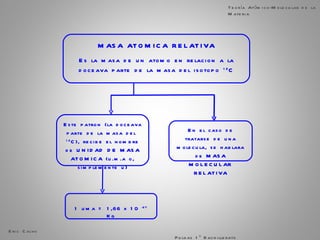
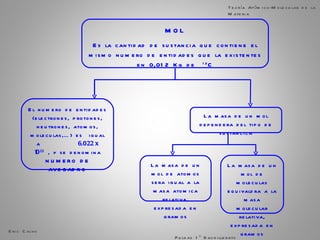
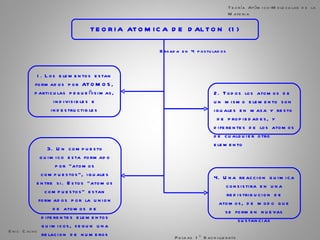
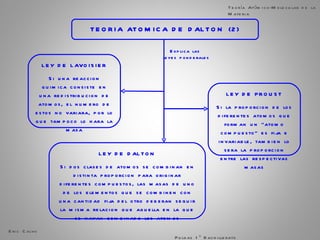
El documento trata sobre la materia. Explica que la materia es todo lo que tiene masa y ocupa espacio, y que puede sufrir cambios físicos o químicos. También describe las propiedades de la materia, los sistemas homogéneos e heterogéneos, y los diferentes métodos para separar mezclas homogéneas y heterogéneas. Finalmente, resume las leyes ponderales como la ley de conservación de la masa y las proporciones definidas en las reacciones químicas.