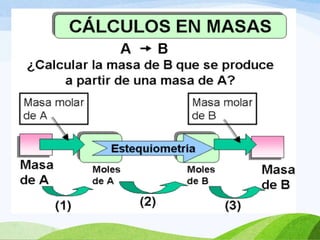
Este documento trata sobre conceptos básicos de estequiometría como reactivo limitante, masa atómica, masa molecular, mol, reacciones químicas, leyes de conservación de la masa y proporciones definidas. Incluye ejemplos de cálculos para determinar el reactivo limitante y el reactivo en exceso en reacciones químicas.