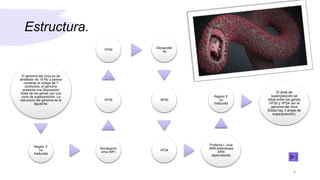
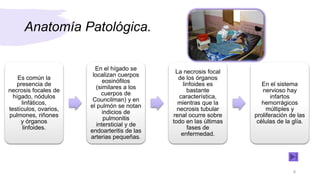
El documento describe el virus de Marburgo, que causa fiebre hemorrágica. Se descubrió en 1967 en Alemania tras una epidemia entre trabajadores de laboratorio expuestos a simios infectados. En 2004 hubo otra gran epidemia en Angola que causó casi 400 casos y 330 muertes. El virus tiene forma irregular y contiene ARN. Se replica dentro de las células y causa necrosis en órganos como el hígado y pulmones. Los mecanismos exactos de patogenicidad siguen sin estar claros.