Este documento trata sobre el tema de la electroquímica. Explica conceptos clave como células voltaicas y electrolíticas, potenciales estándar, y efectos de la concentración sobre el potencial. También describe varias células comerciales importantes como las pilas secas, las baterías de plomo-ácido, y las pilas de zinc-plata. Finalmente, introduce relaciones entre potenciales estándar, cambios de energía libre y constantes de equilibrio.
















![14. Electroquímica
Pt|Fe2+
(0.10 M),Fe3+
(0.20 M)||Ag+
(1.0 M)|Ag(s)
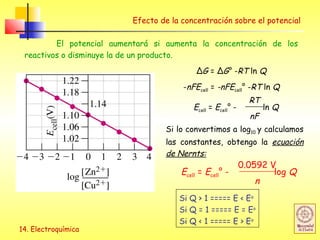
Efecto de la concentración sobre el potencial
Aplicación de la ecuación de Nernst para determinar E
Fe2+
(aq) + Ag+
(aq) Fe→ 3+
(aq) + Ag (s)
Ecell = Ecell° - log Q
n
0.0592 V
Ecell = Ecell° - log
n
0.0592 V [Fe3+
]
[Fe2+
] [Ag+
]
Ecell = 0.029 V – 0.018 V = 0.011 V](https://image.slidesharecdn.com/tema14redox-160401085216/85/Tema-14-redox-18-320.jpg)



![14. Electroquímica
Células comerciales
La célula de Leclanché (Pila
seca)
Zn(s) Zn→ 2+
(aq) + 2 e-
Oxidacion:
2 MnO2(s) + H2O(l) + 2 e-
Mn→ 2O3(s) + 2 OH-
Reduccion:
NH4
+
+ OH-
NH→ 3(g) + H2O(l)
Acid-base reaction:
NH3 + Zn2+
(aq) + Cl-
[Zn(NH→ 3)2]Cl2(s)
Precipitation reaction:](https://image.slidesharecdn.com/tema14redox-160401085216/85/Tema-14-redox-22-320.jpg)





