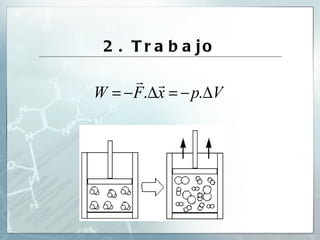
Este documento resume conceptos clave de termoquímica como sistemas termodinámicos, variables termodinámicas, cambios energéticos en reacciones, procesos endotérmicos y exotérmicos, la primera y segunda ley de la termodinámica, entalpía, entropía, energía libre, espontaneidad de reacciones, y aplicaciones energéticas y sus implicaciones sociales y ambientales.