Este capítulo introduce el curso de química de tercer año y explica brevemente la importancia y ubicuidad de la química en la vida cotidiana. Señala que la química nos permite observar el entorno de una manera diferente y que procesos químicos están involucrados en la producción de libros, la visión, y otros aspectos de la vida diaria. El capítulo invita a los estudiantes a emprender un viaje fascinante para aprender sobre este mundo nuevo a través del curso.
















































![Ampliando el horizonte...
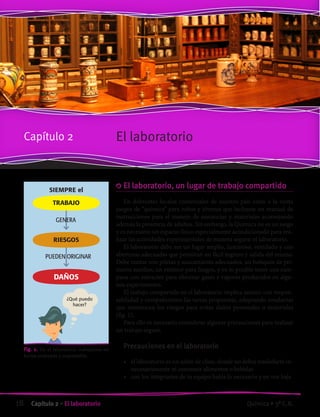
Clasificar es amar
Intervenciones urbanas para reflexionar sobre la basura y su proceso.
“Basurama es la forma que encontró un colectivo de la Escuela de Arquitectura de Madrid
para reflexionar y actuar de forma divertida sobre la basura y los procesos de desecho.
La semana pasada, invitado por el Centro Cultural de España y en marco de la gira Mer-
cosur, el grupo estuvo en Montevideo y conoció los vertederos de basura de la ciudad.
Conversó con clasificadores e instaló su base móvil en distintos puntos de la capital: un
carrito de chorizos y una plaza de cartón en donde realizaron sus acciones.
En el lugar en que un carro de chorizos llevaría su nombre, este carro que no ven-
de nada porta la leyenda Clasificar es amar. [...]
Durante la tarde se van pegando en el cartón muchos signos de pesos. Son recortes
de cinta plástica adhesiva de color blanco con los que Basurama nos dice que la basura es dinero.[...]
Distribuidas al azar sobre la“plaza”hay algunas bolsas negras, gordas, llenas de algo que podría ser
mucha basura pero que solo es una representación. Los signos de pesos se parecen a los que tenían
las bolsas de Tío Rico, aquellas que rellenaba de monedas de oro.
Para Basurama, todo consumo implica un desecho….“La fe en el progreso y el desarrollo nos vuel-
ve ciegos al origen del problema de la generación de basura.”
Basurama, que a esta altura es un proyecto multidisciplinario, realiza foros de reflexión anuales y
actualiza permanentemente una página Web (www. basurama. org) con mucha información sobre
todas las aristas del tema, no solo en España sino también de las ciudades que va conociendo (Méxi-
co, Miami, Santo Domingo, Buenos Aires, Córdoba y Montevideo) y con las que estrecha contacto”.
Extraída y adaptada de “Clasificar es amar”Silvana Burgell (La Diaria- 17 de marzo de 2009) (fig.2)
Un periódico uruguayo publicó dos artículos con el fin de acercarnos a un problema , para reflexionar
y buscar una solución urgente al mismo.
Desechos didácticos
Este verano se desarrollaron juegos ambientales en las playas uruguayas.
“No se trató de jugar con la basura propiamente dicha sino de aprender, jugando con figuras de
polifón que representan distintos tipos de animales y de desechos, sobre el modo en que nuestras
conductas afectan al medio ambiente y los ecosistemas.
La propuesta formó parte del programa Ambientarte propuesto por la ONG El Abrojo y se realizó
en playas uruguayas hasta mediados de marzo”.
Los desechos contaminantes de polifón representan yerba, zapatos, bolsas, etc.
Los niños jugaron con los animales de polifón aprendiendo sus nombres y a reconocer los que
pertenecen a ese ecosistema.
En otro juego, compitieron en equipos y usando guantes de goma descartables, recogieron la“ba-
sura”que luego pesaron para definir el grupo ganador.
Extraída y adaptada de “Desechos didácticos” Florencia Rivas (La Diaria- 17 de marzo de 2009) (fig.1)
57Sistemas. • Capítulo 4Química • 3º C.B.
©EditorialContexto2010-Obsequioparadocentessinvalorcomercial-www.editorialcontexto.com.uy-(02)9019493](https://image.slidesharecdn.com/unidad0y1-130613103124-phpapp02/85/Unidad-0-y-1-55-320.jpg)