Unidad Nº7-VELOCIDADYEQUILIBRIOQUIMICO.docx
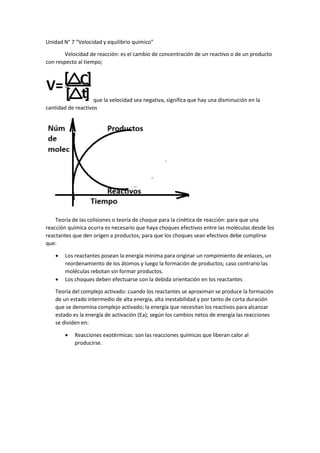
- 1. Unidad N° 7 “Velocidad y equilibrio químico” Velocidad de reacción: es el cambio de concentración de un reactivo o de un producto con respecto al tiempo; que la velocidad sea negativa, significa que hay una disminución en la cantidad de reactivos Teoría de las colisiones o teoría de choque para la cinética de reacción: para que una reacción química ocurra es necesario que haya choques efectivos entre las moléculas desde los reactantes que den origen a productos; para que los choques sean efectivos debe cumplirse que: Los reactantes posean la energía mínima para originar un rompimiento de enlaces, un reordenamiento de los átomos y luego la formación de productos; caso contrario las moléculas rebotan sin formar productos. Los choques deben efectuarse con la debida orientación en los reactantes Teoría del complejo activado: cuando los reactantes se aproximan se produce la formación de un estado intermedio de alta energía, alta inestabilidad y por tanto de corta duración que se denomina complejo activado; la energía que necesitan los reactivos para alcanzar estado es la energía de activación (Ea); según los cambios netos de energía las reacciones se dividen en: Reacciones exotérmicas: son las reacciones químicas que liberan calor al producirse.
- 2. Reacciones endotérmicas: son las reacciones químicas que necesitan calor para producirse Energía de activación (Ea): es la energía mínima requerida para que una colisión entre las partículas sea eficaz, iniciando así el proceso de reacción química; los factores que afectan a la velocidad de las reacciones químicas son: Naturaleza de las sustancias reaccionantes: algunos compuestos reacciones muy fácilmente, otros no. Superficie de contacto entre las moléculas: a medid que disminuye el tamaño de las partículas, aumenta el grado de contacto entre los reactivos. Catalizadores: son sustancias que intervienen en las reacciones químicas acelerándolas o retardándolas; los catalizadores negativos son aquellos que retrasan la velocidad de una reacción y los catalizadores positivos son aquellos que aumentan la velocidad de una reacción química; hay dos tipos de catálisis: o Homogénea: es cuando los reactivos y los catalizadores se encuentran en la misma fase; lo que ocurre es que uno de los reactivos se combina con el catalizador para que luego reacciones con el otro reactivo liberando así el catalizador y obteniendo el producto deseado o Heterogénea: es cuando los enlaces de los reactivos se debilitan por la presencia de un catalizador, obteniendo así el producto deseado; por ejemplo, el proceso de Haber en el que las moléculas de N2 e H2 se unen
- 3. a la superficie de la mezcla Fe/Al2O3/K2O en el cual sus enlaces covalentes se debilitan ocasionando que se disocien ambas moléculas y obteniendo así el NH3 Temperatura: al aumentar la temperatura, las partículas se mueven mas rápido(incrementan su energía) haciendo que hayan mas choques entre las moléculas; para la mayoría de las reacciones químicas, la velocidad de reacción se duplica o triplica aproximadamente cada 10 °C de aumento de la temperatura. Concentración: al aumentar la concentración de los reactivos, se aumentara el numero de colisiones. Ley de velocidad: expresa el producto de las concentraciones de los reactivos elevados a una potencia llamada ordenes de la reacción que se determinarn experimentalmente
- 4. Vr=𝐴 𝑒 −𝐸𝑎 𝑅 𝑇(𝐾) [𝑅1]𝑋 [𝑅𝑛]𝑌 donde X e Y pueden o no ser iguales que a y b X+Y= Orden total de la reacción; donde A es el factor de choque entre las partículas, Ea está en J/mol, R es la constante de los gases que está en 8,314 J/(K . mol) y [R1] a [Rn] son las concentraciones de los reactivos. Ley de acción de masas(LAM): la velocidad de reacción de una reacción química a una temperatura dada es directamente proporcional al producto de las concentraciones de los reactantes, con cada uno de ellos elevados a una potencia numéricamente igual con que aparecen afectadas en la ecuación correspondiente. Vr=𝐴 𝑒 −𝐸𝑎 𝑅 𝑇(𝐾) [𝑅1]𝑎 [𝑅𝑛]𝑏 ; donde 𝐴 𝑒 −𝐸𝑎 𝑅 𝑇(𝐾) es la constante de velocidad(Kv) o ecuación de Arrhenius Ley del equilibrio químico: para una reacción reversible, a una temperatura dada y una vez alcanzado el estado de equilibrio, el producto de las concentraciones de las sustancias formadas dividido por el producto de las concentraciones de las sustancias reaccionantes es un valor constante Kvdirecta [𝑅1]𝑎 [𝑅𝑛]𝑏 = Kvinversa [𝑃1]𝑐 [𝑃𝑛]𝑑 Ke(cte de equilibrio)= 𝐾𝑣𝑑𝑖𝑟𝑒𝑐𝑡𝑎 𝐾𝑣𝑖𝑛𝑣𝑒𝑟𝑠𝑎
- 5. Principio de Le Chatelier: si a una perturbación externa se aplica a un sistema en equilibrio, el sistema se ajusta en cierta forma para que la perturbación se contrarreste parcialmente y el sistema pueda alcanzar una nueva posición de equilibrio Si se aumenta la concentración de reactivos y se eliminan productos, el sistema actua directamente Si se aumenta la concentración de productos y se eliminan reactivos, el sistema actua inversamente; R1+R2P1+Pn Para los gases, si una reacción ocurre sin cambios en el numero de moléculas o moles, los cambios de presión no influyen de ninguna manera; a R1+ a Rn--> a P1+ a Pn Para los gases, si se aumenta la presión, la reacción va hacia donde hayan menos moles; pero si se disminuye la presión, la reacción va hacia donde hayan mas moles
- 6. Un aumento de la temperatura hace que una reacción exotérmica actué inversamente y que actué inversamente una reacción endotérmica. Una disminución de la temperatura hace que una reacción exotérmica actué directamente y actué inversamente una reacción endotérmica. Constante de disociación(Kdis): al alcanzar el equilibrio ionico, el producto de las concentraciones de los iones originados por la disociación del electrolito dividido por el producto de las concetraciones de las sustancias no ionizadas es un valor invariable Kdis= [𝐴−𝑃]ñ[𝐶+ñ]𝑝 [𝐴ñ𝐶𝑝]𝑙 Para electrolitos fuertes la Kdis≥1, es decir que la concentración de los aniones o cationes disociados es igual a .[𝐴ñ𝐶𝑝] 𝑝 = [𝐶+ñ ] para los cationes disociados y [𝐴−𝑃 ] = [𝐴ñ𝐶𝑝] ñ para los aniones, en donde [𝐴ñ𝐶𝑝]es la concentración inicial (Ci) no disociada. Para electrolitos débiles la Kdis<1; para los electrolitos débiles con aniones y cationes monoprocticos la Kdis es: Kdis= [𝑋2] [𝐴𝐶−𝑋] donde X es lo poco que se ha disociado de A- y de C+ , por lo que queda mucho sin ionizar. Ácido: Teoria de Arrhenius: es una sustancia que en medio acuoso produce hidrogeniones (H+ ), el hidronio H3O es un H+ pegado a una molecula de agua (H2O) Teoria de Bronsted: es una sustancia que puede donar un H+ , las reaciones de intercambio de protones son las reacciones de protolisis Los ácidos tienen sabor agrio, hacen virar el papel tornasol al color rosado, producen H2 cuando reaccionan con ciertos metales, producen CO2 cuando reaccionan con carbonatos y bicarbonatos, en agua se disocian permitiendo que conduzcan la electricidad y pierden sus propiedades cuando reaccionan con una cierta cantidad de base(neutralización)
- 7. Base: Teoría de Arrhenius: es una sustancia que en medio acuoso libera iones hidróxido (OH- ) Teoria de Bronsted: es una sustancia que puede aceptar un H+, las reacciones de intercambio de protones son las reacciones de protolisis. Las bases tienen sabor amargo, son resbalosas al tacto, hacen virar el papel tornasol al azul, en agua se disocian permitiendo que conduzacan la electricidad y pierden sus propiedades cuando reaccionan con cierta cantidad de ácido(neutralización) el 7 en ambas escalas análogas significa solución neutra. Los ácidos y bases fuertes son aquellas que ionizan completamente, y la concentración de hidronio o de oxidrilos se calcula como para los electrolitos fuertes como aniones o cationes dependiendo si son ácidos o bases. Los ácidos y bases débiles son aquellos que no ionizan completamente, y la concentración de hidronio o de oxidrilos, para ácidos y bases
- 8. monoprocticas se calcula como aniones o cationes de electrolitos débiles dependiendo si son ácidos o bases: KI(ác)= [𝐴−] [𝐻3𝑂+] [𝐴𝐻−𝐻3𝑂+] KI(bas)= [𝐶+] [𝑂𝐻−] [𝐶(𝑂𝐻)−𝑂𝐻−] pKI(ác)= - log(KI(ác)) pKI(bas)= - log(KI(bas)) pKI(ác)+ p KI(bas)=14 KI(ác) . KI(bas)= 10-14 Efecto del ion común: es el desplazamiento del equilibrio causado por la adición de un compuesto que tiene un ion común con la sustancia disuelta; por ejemplo: si a una solución de NH4 + se le agrega NH4 +en exceso, los iones de NH4 + en exceso obligan al equilibrio de ionización del NH3 a desplazarse en sentido contrario disminuyendo la concentración de OH- Hidrólisis: es la transferencia de un protón entre un ion y el agua: Si el anión de la sal es igualmente débil que el catión, la reacción de estos iones con el agua es despreciable y la solución es neutra (igual concentración de hidrogeniones que de oxidrilos) Si el anión de la sal es igualmente fuerte que el catión, la reacción de estos iones con el agua es apreciable y la solución es neutra. Si el anión de la sal es una base débil, pero el catión es una base fuerte, el anion reacciona muy poco con el agua, pero el catión reacciona apreciablemente con el agua y la solución es acida Si el anión de la sal es una base fuerte, pero el catión es un ácido débil, el anión reacciona apreciablemente con el agua, pero el catión reacciona muy poco con el agua y la solución es alcalina(básica). Neutralización: ácido + base <--> sal+ agua Auto ionización del agua: el agua es un anfolito o anfótero porque se comporta como un ácido cuando reacciona con una base y se comporta como una base cuando reacciona con un ácido. KI(H2O) a 25°C= (conc. de hidronio) x (conc. de oxidrilos) = 10-14
- 9. Espontaneidad de las reacciones de protólisis(neutralización): Ácido 1 + Base 2 <--> Ácido 2 + Base 1 Constante de protolisis(Kp): Kp=KI(ác1)/KI(ác2); con Kp≥1 la reacción es espontanea; si la Kp<1 la reacción no es espontanea. Soluciones amortiguadoras, buffers o tampones: son soluciones electrolíticas que resisten los cambios en la concentración de hidronio y por ende el pH en la adición de pequeñas cantidades de ácidos o de bases están formadas por: Mezcla de un ácido débil y su sal correspondiente Mezcla de una base débil y su sal correspondiente Mezcla de dos sales derivadas de un mismo ácido polivalente débil pH= pKI(ác) – log [ácido/sal] o pH= pKI(ác) – log [ácido/base] pOH= pKI(bas) – log [base/sal] o pOH= pKI(ác) – log [base/ácido] En cualquier buffer uno de los componentes actúa como ácido que neutraliza a las bases que se ingresan al sistema y el otro actúa como base que neutraliza a los ácidos que se ingresan al sistema; al agregar agua a un buffer el pH no se modifica porque la relación entre los componentes permanecen constantes, pero si se reduce la capacidad amortiguadora del buffer porque se disminuyen las concentraciones netas de los componentes del buffer; la máxima capacidad amortiguadora de un buffer se alcanza cuando el pH= pKI(ác) o el pOH= pKI(bas) Reacciones de oxidación y/o reducción(redox): son reacciones donde se produce una transferencia de electrones desde una sustancia que los cede hacia otra que los acepta: Reacción de oxidación: es la pérdida de electrones (e- ), la sustancia que se oxida es el agente reductor. Reacción de reducción: es la ganancia de (e- ), la sustancia que se reduce es el agente oxidante. Electricidad por vía química: las reacciones redox son procesos electroquímicos: Ánodo (-): electrodo en el que se lleva a cabo la reacción de oxidación, es la parte de la pila que pierde electrones.
- 10. Cátodo (+): electrodo en el que se lleva a cabo la reacción de reducción, es la parte de la pila que gana electrones. .𝐴1 0 + 𝐵2 + < −−> 𝐵1 0 + 𝐴2 + ,del cual: pares redox: 𝐴2 + 𝐴1 0 y 𝐵2 + 𝐵1 0 Potencial de reducción (E): es la tendencia de una sustancia de aceptar electrones; algunas sustancias tienen un potencial de reducción tabulado (potencial estadndar de reducción E0) para [1M] y a temperatura y presión estándar (TPE) Fuerza electromotriz (FEM): es toda causa capaz de mantener una diferencia de potencial entre dos puntos de un circuito abierto o de producir una corriente eléctrica en un circuito cerrado; FEM= Ecátodo – Eánodo FEM0= E0cat-E0an Teoría de Nerst del potencial del electrodo: todo elemento capaz de formar un electrodo activo al introducirlo en agua o en una disolución, tiene una tendencia de disolverse dando iones a la disolución, esta tendencia se conoce como presión electrolítica de la disolución: Ecuación de Nerst: cuando disminuye la concentración del oxidante de un par, disminuye el potencial de reducción; FEM= FEM0 – (0,0592/ne ) log[Ke], donde ne son los electrones que cambian el estado de una molécula o átomo (electrones de las semirreacciones) Espontaneidad de las reacciones de oxidación-reducción: una reacción redox es espontanea cuando la FEM de la celda es positiva; los potenciales de reducción de los cátodos y de los ánodos se pueden poner como pares redox Leyes de Faraday: Primera: la masa depositada o liberada en un electrodo es directamente proporcional a la corriente que circula; Q(cant de carga)= i(corr. Que circ) x t = C(Columbios) seg Segunda: para una misma cantidad de corriente, las masas depositadas de diferentes elementos son proporcionales a sus pesos equivalentes; para las reacciones redox: PE=PA del elemento/ne 1 mol de electrones tiene una carga de:
- 11. NA (1,6022 10-19 coulumbios)= 96486,6742 C Tmax= - ne F FEM Celda electroquímica: es un dispositivo experimental para generar electricidad mediante una reacción química espontanea: Pila de Daniell o celda galvánica o celda voltaica: voltaje de 1,1 V Zn−−> Zn2+ + 2 e – Cu2+ + 2e – −−> Cu -------------------------- Zn + Cu2+ −−> Zn2+ + Cu Pila de Lenclanché o seca: voltaje de 1,5 V
- 12. Batería de mercurio: voltaje de 1,35 V Acumulador de plomo: voltaje de 2 V. Al suministrarle corriente se generan los reactivos.
- 13. Batería de litio: voltaje de 3,4 V. Al suministrarle corriente se regeneran los reactivos. Li−−> Li++ 1 e – CoO2 +4 + 1e – −−> CoO2 +3 -------------------------- Li + CoO2 +4 −−> Li+CoO2 +3
- 14. Electrólisis – electrodeposición: es el proceso en el que se usa energía eléctrica para hacer que una reacción química no espontanea tenga lugar; se usan celdas electroquímicas: Obtencion del aluminio: O-2 −−> O2+ 2 e – Al+3 + 3e– −−> Al -------------------------- 2 Al2O3−−> 4 Al + 3 O2
- 15. Electrolisis del agua:
- 16. Corrosión: es el deterioro de los metales por un proceso electroquímico; esto se explica por: La formación de pequeñas pilas locales entre el metal base y algún otro metal presente como impureza La corrosión comienza en aquellos lugares en donde el metal presenta alguna anormalidad. Por ejemplo, la corrosión del hierro: Ánodo: Fe+2 −−> Fe+3 + 1 e – O2 + 2 e– −−> O-2 -------------------------- Fe+2 + O2 + H2O −−> Fe2O3 . H2O + H+ Cátodo: Fe−−> Fe+2 + 2 e– O2 + 4 H+ + 2 e- −−> H2O -------------------------- Fe+ O2 + 4 H+ −−> Fe+2 + 2 H2O
- 17. Protección catódica contra la corrosión: consiste en convertir en cátodo al metal que se quiere proteger: Protección catódica utilizando magnesio (Mg): Mg + O2+H+ −−> Mg+2 + H20