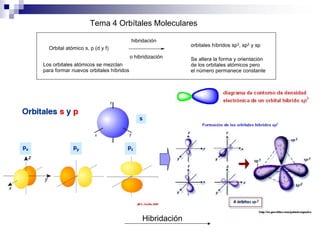
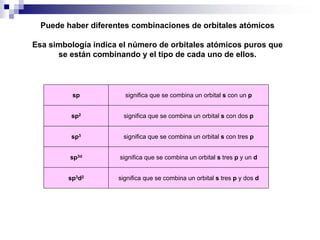
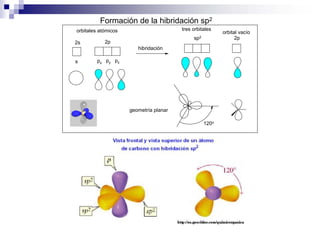
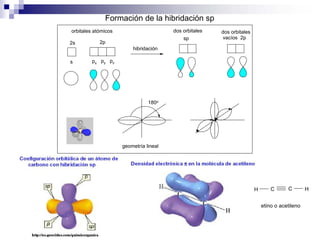
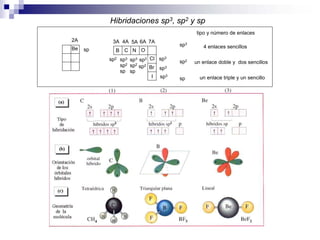
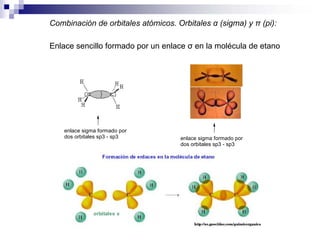
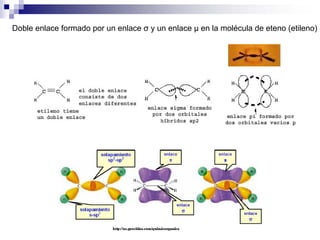
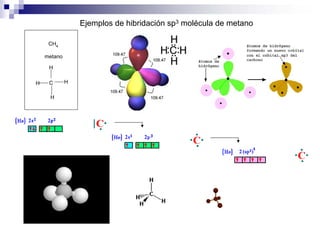
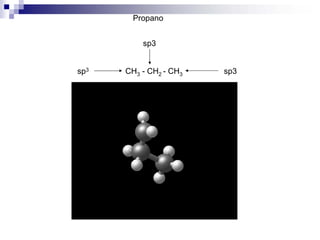
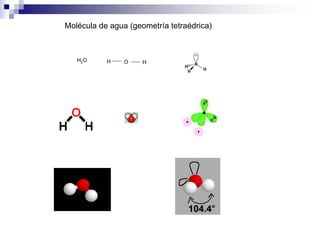
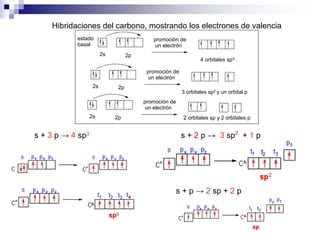
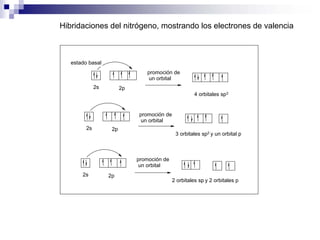
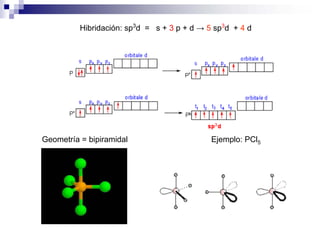
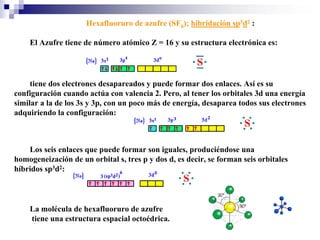
1) La hibridación implica la recombinación de orbitales atómicos puros para formar nuevos orbitales híbridos.
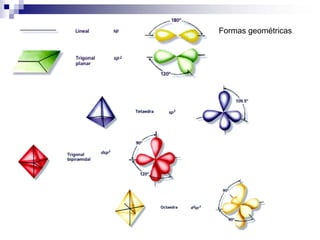
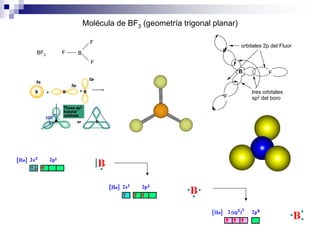
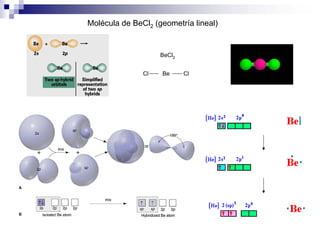
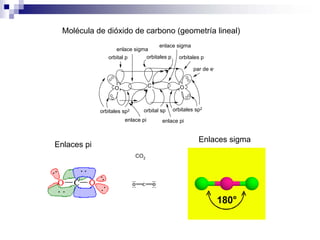
2) Existen diferentes tipos de hibridación (sp3, sp2, sp) que dan lugar a geometrías moleculares distintas (tetraédrica, planar, lineal).
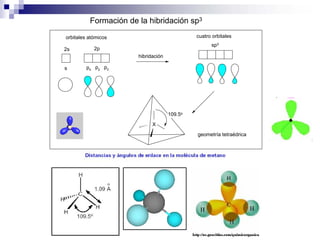
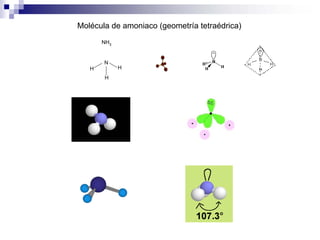
3) La hibridación sp3 se da en moléculas como el metano y forma enlaces con ángulo de 109.5° en geometría tetraédrica.