PCR en tiempo real para detección de ADN
- 2. Agarosa L a a g a r o s a e s u n p o l í m e r o n a t u r a l , p o l i s a c á r i d o f o r m a d o p o r g a l a c t o s a s a l f a y b e t a q u e s e e x t r a e d e l a s a l g a s d e l o s g é n e r o s G e l l i d i u m y G r a c i l l a r i a S o l u b l e a t e m p e r a t u r a s u p e r i o r a l o s 6 5 º C Te m p e ra t u ra d e g e l i f i c a c i ó n v a r í e e n t re l o s 1 7 y l o s 4 0 º C S u u s o m á s e x t e n d i d o e s p a r a c o n s t r u i r g e l e s q u e p e r m i t a n s e p a r a r m o l é c u l a s d e A D N m e d i a n t e e l e c t r o f o r e s i s
- 3. Gel de agarosa El tamaño de poro efectivo de los geles de agarosa se puede estimar a partir de gráficos de Ferguson de moléculas de ADN de diferentes tamaños
- 4. Peso de agarosa Ilustración 2: Rango de separación de tamaños de ADN en función de la concentración y el tipo de agarosa utilizados (Stellwagen, 2010).
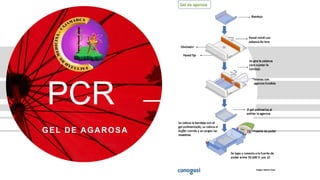
- 5. Protocolo Ilustración 3: Etapas de la técnica (Fierro). 1. Preparación del gel agarosa 2. Preparación de las muestras 3. Carga de las muestras y corrida del gel 4. Tinción del gel y visualización del ADN
- 6. Preparación del gel agarosa Ilustración 4:Un gel de agarosa solidificado después de retirar el peine (Lee, Costumbrado, Hsu, & Kim, 2012) 1. Pesar la cantidad de agarosa necesaria para obtener la concentración deseada en función del volumen de gel. 2. Añadir la agarosa al buffer en un matraz. 3. Calentar la mezcla en un horno de microondas hasta que se observe que toda la agarosa se ha fundido. 4. Dejar enfriar la solución de agarosa hasta una temperatura de unos 50 °C. 5. Mientras la solución de agarosa se enfría, preparar el molde en el que se va a hacer el gel sellando los bordes con cinta masking, o colocándolo en el dispositivo previsto para ello, y colocando el peine en la posición deseada. 6. Verter cuidadosamente la solución de agarosa sobre el molde nivelado y dejar que solidifique durante al menos 30 min.
- 7. Preparación de las muestras Ilustración 5:Una estudiante que agrega colorante de carga a sus muestras de ADN (Lee, Costumbrado, Hsu, & Kim, 2012) Mezclar tanto las muestras de ADN como el marcador de tamaño con 0.2 volúmenes del buffer de carga 6x. El volumen total estará determinado por el tamaño de los pocillos, habitualmente 15-30 µl
- 8. Carga de las muestras y corrida del gel Ilustración 6:Un estudiante cargando la muestra de ADN en un pozo del gel. (Lee, Costumbrado, Hsu, & Kim, 2012) 1. Una vez que el gel ha solidificado retirar el sellado de los bordes y colocar el molde con el gel en la cámara de electroforesis. 2. Añadir buffer de electroforesis hasta que cubra el gel unos 3-5 mm. 3. Retirar cuidadosamente el peine para que queden libres los pocillos para las muestras. 4. Cargar en los pocillos las muestras que se prepararon en el paso. 5. Conectar los cables a la fuente alimentación y aplicar un voltaje de 20-150 V 6. Correr el gel hasta que el colorante azul de bromofenol esté a una distancia del borde de aproximadamente un 25% de la longitud total del gel. En ese momento debe detenerse la electroforesis.
- 9. Tinción del gel y visualización del ADN Ilustración 7: Imagen de una electroforesis post- gel. El gel se expuso a luz ultravioleta y la fotografía se tomó con un sistema de documentación de gel (Lee, Costumbrado, Hsu, & Kim, 2012). 1. Si no se añadió el BrEt al gel, éste debe teñirse una vez finalizada la electroforesis. Para ello se saca el gel de su molde y se sumerge en una solución de BrEt (0.5 µg/ml) durante al menos 15 min. 2. Colocar el gel sobre un transiluminador y encender la lámpara de luz ultravioleta (λ ≈ 300 nm), el ADN se visualizará como bandas de color anaranjado. 3. Si hay bandas de tamaño pequeño que no se visualizan bien puede hacerse una etapa de desteñido con H2O o 1 mm MgSO4 durante 20 min. 4. Fotografiar el gel con el sistema fotográfico disponible.
- 10. https://www.youtube.com/watch?v=mRUAAq3hACY Electroforesis Electroforesis en gel agarosa https://www.youtube.com/watch?v=U1g2qt3juZw
- 12. Fundamento • El objetivo de la PCR en tiempo real ha sido detectar y cuantificar las secuencias específicas de ácidos nucleicos mediante el uso de reporteros fluorescentes en la reacción. • El término en tiempo real se refiere a que la detección de los productos amplificados sucede en cada ciclo de la reacción y por su parte, el término cuantitativo hace referencia a que es posible cuantificar la cantidad de ADN en la muestra. • Estas últimas dos características representan grandes ventajas de la PCR en tiempo real, ya que el producto de amplificación es monitoreado conforme transcurre la reacción sin que haya la necesidad de que sea manipulado en un gel de agarosa para conocer si la reacción fue exitosa como sucede en la PCR.
- 13. Equipos para realizar la PCR en tiempo real Termociclador Fluorómetro
- 14. Equipos para realizar la PCR en tiempo real A) Mecanismo de incorporación del SYBR Green. Durante la alineación del iniciador, el SYBR Green se incorpora en la doble cadena. La señal de fluorescencia incrementa de manera proporcional a las moléculas de doble cadena producidas en la amplificación. Una sonda es una secuencia de ADN o ARN de cadena simple que se utiliza para encontrar su secuencia complementaria en el genoma de una muestra • Sondas de Hidrólisis • Sondas de Hibridación • Sondas de Horquilla Fluoróforos con afinidad por el ADN Sondas
- 15. Sondas de hidrólisis Taq Man Ilustración 11: Estructura y mecanismo de acción de la Sonda TaqMan (Navarro, Serrano-Heras, Castaño, & Solera, 2015) Ilustración 12: Método específico mediante la utilización de las sondas TaqMan. (L, C, & C, 2013)
- 16. CYBR Green Ilustración 13: Método no específico. Cuando el CYBR Green está unido al ADN de doble cadena, es excitado a una longitud de onda de 480 nm, mientras que la longitud de onda de emisión corresponde a 50nm (L, C, & C, 2013).
- 17. Sondas de hibridación Sondas de Horquilla En este caso se utilizan dos sondas específicas que hibridan con la secuencia del ADN de interés. En estas sondas, un oligonucleótido marcado en su extremo 5’ con un reportero y el 3’ con un apagador, se encuentran formando una horquilla, estructura que los mantiene cercanos para poder llevar a cabo la transferencia de energía y mantener al reportero apagado.
- 18. Protocolo Ilustración 14: Etapas de la técnica (Aguilera, Tachiquín, Munive, Olvera, & Cárdenas).
- 19. 1. Preparar una curva de calibración (ADN) con estándares certificados a diferentes concentraciones . 2. Reacciones de amplificación. Preparar por duplicado la mezcla de reacción, una para el marcador endógeno y otra para p35s.
- 20. 3. Las muestras del ADN que van a ser analizadas deben mantenerse en hielo hasta que se coloquen en la placa o en los tubos PCR. Procesar cada muestra por duplicado. 4. Todos los reactivos para la PCR deberán descongelarse y homogeneizarse, cuidadosamente. Mantenerse sobre hielo y tapados para evitar que reciban la luz directa. 5. Colocar 23 µL de la mezcla de reacción en cada tubo . 6. Agregar 2.0 µL del ADN problema a cada tubo . 7. Una vez preparadas las mezclas, centrifugar los tubos para eliminar burbujas que pudieran interferir con la lectura de la fluorescencia y la solución quede en el fondo de los tubos. 8. Preparar el equipo y programar las condiciones para la amplificación. 9. Ejecutar el programa. 10. Obtención de datos.
- 22. PCR en tiempo real https://www.youtube.com/watch?v=C_luFY8mG2g https://www.youtube.com/watch?v=vLya5A_TlPs Real Time PCR Detection Kits. Extracción de ácidos nucléicos & Protocolo de Iniciación
- 24. Fundamento • Ahorro de tiempo • Sensibilidad extrema • un amplio rango dinámico La PCR cuantitativa en tiempo real es un método altamente sensible para cuantificar la cantidad absoluta o relativa de una secuencia de ácido nucleico específica en la que la acumulación de productos de PCR a lo largo del tiempo se mide directamente. El paso de información de RNA a DNA puede ser posible a la acción de un enzima particular denominada transcriptasa inversa o retrotranscriptasa. La técnica de la qRT-PCR permite analizar la expresión génica y compararla en distintas condiciones. Las aplicaciones comunes de qPCR incluyen el perfil de expresión génica, la cuantificación de la carga viral.
- 25. ETAPAS
- 26. OBTENCIÓN, AISLAMIENTO Y PURIFICACIÓN DEL mRNA 1. En una hoja Excel calcular el volumen que hay que añadir de cada muestra para preceder a la eliminación DE gDNA. 2. Hacer los cálculos necesarios. 3. Pipetear los volúmenes correspondientes en tubos libres de RNAsas, siguiendo estrictamente las normas para no contaminar las muestras 4. Incubar 3 minutos a 42ºC . 5. Pasar inmediatamente a hielo.
- 27. Ilustración 16: Estructuras DNA y RNA. Diferente composición de bases nitrogenadas
- 28. RETROTRANSCIPCIÓN La retrotranscripción (reacción RT) es un proceso por el que una hebra de RNA se retrotranscribe en una cadena complementaria, que llamamos cDNA. Enzima retrotranscriptasa dNTPs Cebador Buffer Primers • Primer oligo • Primers específicos • Random primers
- 30. Protocolo 1. Se parte de máximo 1 µg de RNA. 2. Se añaden, a cada muestra, las cantidades necesarias de enzima RT y de buffer RT 3. Preparamos uno de los controles necesarios para la qRT-PCR: control RT- 4. Incubar todas las muestras y sus controles 15 minutos a 42ºC 5. Inactivar el enzima: 3 minutos a 95ºC 6. Guardar en hielo o almacenar a -20ºC hasta la realización de la qRT-PCR.
- 31. AMPLIFICACIÓN DEL cDNA Ilustración 18: Sonda Taq Man intacta y rota por la acción de la DNA polimerasa Fase de desnaturalización del cDNA Fase de annealing Fase de elongación
- 32. Ilustración 20: Fases de la qRT-PCR. Durante la elongación, se produce la liberación de la molécula fluorescente de la sonda Taq Man
- 35. Diseño de placa e inicio de la programación • El soporte donde se lleva a cabo la reacción es una placa de 96 pocillos. • En nuestro caso, nuestra referencia activa será el gen que codifica el enzima gliceraldehido3-fosfato deshidrogenasa (GAPDH). • Añadir los controles RT- y NTC • Teniendo en cuenta que cada muestra y su control deben probarse por duplicado, diseñar las placas que nos permita en análisis de los genes INS1, INS2 y GADPH. • Una vez diseñada la placa, en cada pocillo, se pipetearán los volúmenes correspondientes para obtener un volumen final de 20 μl, que incluya los siguientes componentes: • Mix (DNA polimerasa, dNTPs, cofactores,) 10 μl • Sonda TaqMan específica para cada uno de los tres genes junto a su pareja de primers correspondiente 1 μl • H2O 5 μl • Muestra de cDNA o su correspondiente control RT- o Agua (NTC): 4 μl.
- 36. Se irá realizando el diseño y ajuste de los parámetros en el programa correspondiente teniendo en cuenta que ha sido programado previamente 1. Seleccionar los genes que vamos a estudiar de la lista existente: 2. Identificar en cada pocillo, qué gen es el que vamos a estudiar, y de qué paciente se trata. Colocar también los controles NTC y RT-
- 37. Visualización de los resultados Análisis 1.Eliminar los pocillos cuya medida se observe alterada 2. Ajustar el umbral de detección determinado automáticamente por el software, situándolo en la zona lineal, en dos puntos diferentes y observar los cambios en los Ct.
- 38. Cada gen debe ser analizado por separado y en conjunto para todas las muestras del experimento que estamos llevando a cabo. Es decir, habrá que establecer un umbral único para INS1 en TODAS las muestras (no para NTC ni para RT- ). Otro distinto para INS2 y otro distinto para GAPDH.
- 39. Observar estos cambios en el display de los datos “Plate” (Cts de cada uno de los pocillos).
- 40. Cuantificación relativa: Método 2-ΔΔCt 1. En la plantilla de Excel calcular el incremento de Ct (ΔCt). Para ello, se resta a la media de los Cts del gen a evaluar (INS1 e INS2) la media de los Cts del gen control (GAPDH) en cada muestra. 2. Representar las gráficas de los valores de ΔCt por un lado, y de los valores de 2-ΔΔCt