Sistema proteico muscular
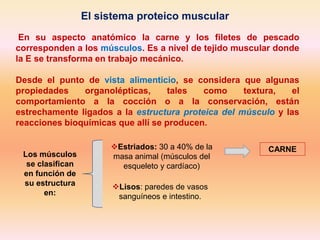
- 1. El sistema proteico muscular En su aspecto anatómico la carne y los filetes de pescado corresponden a los músculos. Es a nivel de tejido muscular donde la E se transforma en trabajo mecánico. Desde el punto de vista alimenticio, se considera que algunas propiedades organolépticas, tales como textura, el comportamiento a la cocción o a la conservación, están estrechamente ligados a la estructura proteica del músculo y las reacciones bioquímicas que allí se producen. Los músculos se clasifican en función de su estructura en: Estriados: 30 a 40% de la masa animal (músculos del esqueleto y cardíaco) Lisos: paredes de vasos sanguíneos e intestino. CARNE
- 2. La fibra muscular es una célula gigante que mide de un milímetro a varios cm de longitud y de 10 a 100 mm de D. Contiene un centenar de cuerpos filamentosos orientados paralelamente al eje de la fibra: las miofibrillas. El citoplasma fibrilar o sarcoplasma, en el que están enmarcadas las miofibrillas, contiene los núcleos y las mitocondrias Cada miofribrilla está rodeada por el retículo sarcoplasmático que interviene en la transmisión del influjo nervioso Músculo
- 3. El músculo contiene 55-78 % de agua 15 -22% de proteínas 1-15 % de lípidos 1-2 % de glúcidos 1 % de sales minerales Las proteínas representan del 50 al 95% de la materia orgánica de la carne Por esta razón La mayor parte de los estudios sobre calidad de las propiedades de la carne, se realizan sobre las proteínas musculares. Las proteínas musculares pueden clasificarse en función de su localización. Proteínas sarcoplasmáticas, Proteínas del tejido conjuntivo Proteínas de las miofibrillas
- 4. Características de las proteínas del esqueleto de un mamífero g/100g de P Masa Molar P. Miofibrilares 51,5 Miosina 27 475.000 Actina 11 41.785 Tropomiosina 4,3 70.000 Troponinas 4,3 72.000 Proteína M 2,2 160.000 Proteína C 1,1 140.000 a- actina 1,1 206.000 b- actina 0,5 70.000 P. Sarcoplasmáticas 32,5 Enzimas mitocond. y P solubles 30 Mioglobina 1,5 17.800 Hemoglobina 0,5 67.000 Citocromo, flavoproteínas 0,5 P. del Estroma 16 Colágeno 8 300.000 Elastina 0,5 < 70.000 Proteínas insolubles 7,5
- 5. Proteínas sarcoplasmáticas Se trata de proteínas solubles a pH próximos a la neutralidad y a fuerzas iónicas inferiores a 0,1. Constituyen del 30 al 35% de las proteínas totales del esqueleto. Son un conjunto heterogéneo de proteínas diferentes que contienen todos los enzimas que participan en la glicólisis, y enzimas vinculadas al metabolismo de glúcidos y proteínas. La pigmentación roja de los músculos se debe principalmente a una heteroproteína: la mioglobina La mioglobina es el principal determinante del color de las carnes (90%). Su concentración varía entre 0,5 a 7 mg/g de músculo; aumenta con el ejercicio, la edad y la altitud, por el contrario disminuye si la dieta es deficitaria en Fe
- 6. La mioglobina fue la primera proteína a la que se determinó su estructura tridimensional por cristalografía de rayos X en 1957. Es una proteína extremadamente compacta y globular, en la que la mayoría de los aminoácidos hidrofóbicos se encuentran en el interior y muchos de los residuos polares expuestos en la superficie. Alrededor del 75% de la estructura secundaria tiene una conformación de a-hélice Una imagen de difracción de cristalografía de rayos X de la proteína
- 7. La oximioglobina constituye para el músculo una reserva de oxígeno y lo transporta hasta el nivel de los tejidos Las modificaciones de la mioglobina originadas por los tratamientos tecnológicos condicionan el color de la carne y los productos cárnicos, los principales derivados son: Desoximioglobina : pigmento natural de la carne, tiene Fe2+ Oximioglobina: corresponde a un complejo mioglobina-Fe2+-O2, estable cuando la Presión parcial de oxígeno es elevada, tal como ocurre en la superficie de la carne fresca. Metamioglobina es una forma oxidada de la mioglobina, en la cual está presente el Fe3+. Se trata de un pigmento oscuro indeseable. La preservación de la carne necesita condiciones en las cuales predomina la forma reducida. Numerosos derivados: nitroso, carboxi, y otros
- 8. Piezas de carne de cordero con la mioglobina en forma de oximioglobina (izquierda) y metamioglobina (derecha). Mb-Fe2+O2 Mb-Fe3+ + O2 •-
- 9. Son las proteínas menos solubles del músculo. Las dos proteínas principales de tejido conjuntivo son el colágeno y la elastina El colágeno es el constituyente principal del tejido conjuntivo, se encuentra en los huesos, piel, tendones, cartílagos, músculo y sistema cardiovascular. Es una proteína fibrosa no elástica con funciones de protección La elastina abunda en las paredes de arterias y en los ligamentos de la vértebras a los que confiere un color amarillento típico Representan más del 50% de las proteínas totales del músculo Son solubles en soluciones salinas de baja fuerza iónica, y confieren al músculo su propiedad contráctil a través de las proteínas: miosina y actina Proteínas del estroma Proteínas miofibrilares
- 10. En tecnología alimentaria, estas proteínas influyen en las calidades culinarias y comerciales de las carnes pues son las responsables, por ejemplo de: La capacidad de retención de agua (el 70 a 95% del agua presente en el músculo corresponde a agua aprisionada en los espacios entre los filamentos proteicos de la miofifrilla) Las propiedades emulsionantes En menor grado de la blancura de la carne Además contienen cantidades importantes de AA esenciales y contribuyen en más del 70% al aporte proteico, debido al consumo de carne
- 11. Particularidades del sistema proteico muscular del pescado: Las principales diferencias con los animales de sangre caliente son: -El contenido de tejido conjuntivo es menor en el músculo de pescado (las proteínas del estroma representan un 3- 10%). -La temperatura de gelatinización es una decena de grados inferior -Las fibras musculares del pescado son cortas -la miosina, que representa un 40% de las proteínas totales, es difícil de separar de la actina. Esta proteína es más sensible a la desnaturalización y a la proteólisis. -La rigidez cadavérica y la maduración son fenómenos relativamente rápidos en el pescado. El descenso post morten del pH es menor de 7 a 6,5- 6,2 lo que confiere al pescado una inestabilidad microbiológica mayor.
- 12. Influencia de los tratamientos tecnológicos sobre proteínas musculares Influencia de la temperatura Durante la cocción intervienen numerosas modificaciones sobre las proteínas musculares, algunas se traducen por un aumento de la dureza pero otras por el contrario por una mayor blandura, Así la carne de vaca presenta durante la cocción dos fases distintas: Endurecimiento entre 40 y 55 °C se produce la desnaturalización proteica contráctil Retracción del colágeno entre 65 y 70 °C Hasta 65 °C la miofifrina se proteoliza parcialmente lo que motiva la aceleración del fenómeno de maduración; a partir de 70°C el colágeno se desnaturaliza y pasa en solución, por encima de 100 °C las miofibrillas sufren hidrólisis no específicas. Pero además, la cocción afecta a la carne en otras tres fases:
- 13. La importancia relativa de estas fases durante la cocción son función de la naturaleza de la carne, de la proporción y “edad” del colágeno y del grado de rigidez cadavérica adquirido. Además influyen sobre la calidad de las carnes la duración y temperatura de calentamiento, Una cocción lenta favorece el ablandamiento en torno a los 60 °C, los fenómenos de maduración se aceleran y hacia los 90 °C se solubiliza el colágeno. La cocción va generalmente acompañada por un aumento de pH (entre 0,3 y 1 unidad de pH). a) Influencia de la T sobre las proteínas sarcoplasmáticas La mayor parte de estas proteínas se desnaturalizan y forman agregados entre 40 y 60°C. La desnaturalización de la mioglobina es el origen de los cambios de color de las carnes durante la cocción (de rojo a parduzco). El principal pigmento formado es el ferrihemocromo pardo. Hasta 50°C la carne conserva su color: entre 50 y 70 °C se hace blanquecina (precipitación de las proteínas) y suelta un jugo rojizo; por encima de 70°C se obscurece y el jugo pierde su color a causa de la desnaturalización de la mioglobina.
- 14. b) Influencia de la T sobre las proteínas del tejido conjuntivo La primera modificación sufrida por el colágeno durante el calentamiento se caracteriza por un acortamiento de la longitud de la molécula en aproximadamente un tercio. Este fenómeno aparece hacia los 55°C y la mitad de las fibras de colágeno lo presentan en torno a los 61 °C. Esta modificación rápida va seguida de la solubilización de esta proteína, la cual aumenta con la T (entre 60 y 100 °C), se forma gelatina. La cocción bajo presión a 115 a 125°C, permite una solubilización muy rápida del colágeno. La gelatina se caracteriza por una débil resistencia al corte y buena capacidad para retener agua. Contrariamente al colágeno, la elastina se modifica poco durante la cocción. En presencia de agua y a temperaturas próximas a 100 °C, la elastina se “hincha” pero aún conserva la mayor parte de las propiedades. El ablandamiento de carnes con alto contenido en elastina se realiza por proteólisis, en especial con la ayuda de proteasas de origen vegetal.
- 15. c) Influencia de la T sobre las proteínas miofrilares La solubilidad de las proteínas miofibrilares disminuye entre 40 y 60°C, se produce un desplazamiento de las cadenas polipetídicas que se asocian y coagulan. Con temperaturas superiores a 75°C, se producen reacciones de desulfuración con formación de sulfuro de hidrógeno. Este puede causar el ennegrecimiento de los envases de conservas de carne. La cocción provoca una disminución de la capacidad de retención de agua de las proteínas miofibrilares, así una gran proporción del agua muscular que se libera durante la cocción forma el jugo y el resto se incorpora a la gelatina. La cocción de las carnes se traduce por numerosas modificaciones de las cualidades organolépticas. La producción de sulfuro de hidrógeno y de compuestos azufrados contribuyen al sabor de las carnes cocidas, Las reacciones Maillard aparecen claramente en torno a los 90 °C que conjuntamente con las reacciones de pirolisis de los glúcidos, contribuyen al obscurecimiento de las carnes cocidas.
- 16. Influencia de la Congelación La congelación es un medio excelente para conservar carnes, sin embargo va seguida del deterioro de algunas de sus cualidades. Esto se debe principalmente a los daños que sufren las proteínas musculares y membranas celulares, cuyas modificaciones se acusan sobre todo por una pérdida de agua durante la descongelación, unida a un descenso de jugosidad y cambios de textura ligados al endurecimiento de los sarcómeros y desnaturalización de proteínas. Para una carne determinada estas modificaciones son función de la velocidad de congelación, temperatura mínima alcanzada y duración del almacenamiento. La congelación de las carnes, comienza entre -1 y 2 °C; a -1 °C el 2% del agua se encuentra bajo la forma de hielo y a -2°C el 50%. La concentración en solutos aumenta en el agua no congelada, lo que rebaja su temperatura de congelación. En el punto eutéctico la solución está saturada y el soluto y hielo se solidifican conjuntamente,
- 17. A las temperaturas usuales de congelación (de -20°C a -35°C) el 90% del agua está congelada, lo que hace aumentar 10 veces la concentración en solutos del agua no congelada. En las zonas donde está presente esta solución, se produce una acusada desnaturalización de las proteínas, debido al aumento de la fuerza iónica y las variaciones de pH. La congelación puede dañar las estructuras celulares. Durante una congelación lenta: Se forman grandes cristales de hielo en el medio extracelular, debido probablemente, a que su presión osmótica inicial es inferior a la del medio intracelular. A causa de esto se produce una transferencia de agua del medio intracelular hacia el extracelular. La fuerza iónica aumenta considerablemente en el medio intracelular, la célula se plasmoliza y sus proteínas se desnaturalizan. Las lesiones celulares permiten que las lipasas se pongan en contacto con sus sustratos y en el medio aparecen ácidos grasos libres.
- 18. Durante una congelación rápida: Se forman numerosos cristales de hielo en la carne y son mínimas las transferencias de agua entre los medios extra e intracelular, por eso la desnaturalización de proteínas resulta mínima. La principal consecuencia de la desnaturalización de proteínas es un descenso de su capacidad de retención de agua, lo que produce durante la descongelación un fuerte exudado, que contiene vitaminas, sales minerales y aminoácidos, aunque el descenso del valor nutritivo es muy bajo, la pérdida de peso en la carne puede ser muy importante y además la textura puede hacerse seca y fibrosa.
- 19. Influencia de la deshidratación La deshidratación de la carne (incluida la liofilización) va unida a una disminución de su capacidad de retención de agua después de la deshidratación y a un endurecimiento de su textura. Estas modificaciones son el resultado de interacciones entre moléculas de actomiosina por intermedio de numerosas uniones salinas. La presencia de azúcares atenúa este fenómeno. Carne deshidratada de cordero Carne deshidratada de pollo Diferentes tipos de Carne deshidratada
- 20. Efectos de la estimulación eléctrica sobre la carne. En la evolución postmortem de las carnes, la hidrólisis del ATP conduce a la contracción y descenso del pH. Si la T baja rápidamente a – de 10 °C persiste (a pH >6) la actividad ATPasica de la miosina y los iones Ca se liberan del retículo sarcoplasmático. El músculo adquiere la rigidez cadavérica en un estado contraído, lo que motiva una alteración irreversible de la textura. Para impedir esta contracción desfavorable del frío, se somete al músculo inmediatamente después de la muerte, a una estimulación eléctrica “caliente” para bajar el pH por hidrólisis del ATP a valores inferiores a 6. En respuesta a este estímulo el retículo sarcoplasmático libera en el medio iones Ca y surge la contracción muscular.
- 21. Así a 30 °C, un tiempo de estímulo próximo a 2 min, con una tensión máx de 600 voltios y una frecuencia de 15 Hz, consigue descender el pH hasta 6 en bovinos grandes. Este fenómeno es reversible y cuando el estimulo cesa, el retículo retoma iones Ca y el músculo entra en relajación porque aún queda suficiente ATP para disociar actina y miocina. Cuando la T de la carne así tratada alcanza valores inferiores a 10 °C, se liberan durante la refrigeración los iones Ca del retículo, pero la contracción disminuye debido a la débil concentración de ATP y la disminución de actividad de la miosina a pH< a 6. Entonces el músculo entra en un estado de rigidez cadavérica “ no contraída”. El estímulo provoca una maduración más rápida, así como el realizar el deshuesado del canal en las horas que siguen a la muerte y un enfriamiento inmediato (con mejora de calidad microbiológica) El deshuesado en caliente realizado sin estimulación eléctrica previa, aumenta el peligro de descenso de textura por el frío, porque la contracción no está limitada por las ligazones músculo-hueso.
- 22. Son numerosas las ventajas tecnológicas y económicas del deshuesado en caliente de los canales previamente sometidos a estímulo eléctrico: -Ahorro de energía de refrigeración -Limitar la evaporación de agua durante el almacenamiento por el rápido acondicionamiento de las carnes y el adaptar a cada parte del animal el tratamiento de maduración y conservación convenientes. Investigación de la UN de Entre Ríos Estudian procedimientos tecnológicos que permitan a la industria avícola aumentar la velocidad de producción sin perder calidad. La evidencia científica demuestra que la aplicación de estimulación eléctrica de alto voltaje es la que mejores resultados da consiguiéndose reducir hasta un 50 por ciento el tiempo de maduración cuando se aplica correctamente. En estudios donde el tiempo mínimo requerido fue de 4 horas se ha visto que el mismo pudo ser reducido a dos horas.