Reacciones catalizadas por solidos.pptx
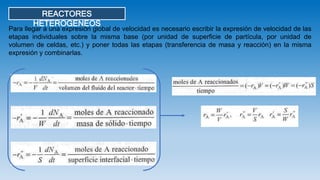
- 1. REACTORES HETEROGENEOS Para llegar a una expresión global de velocidad es necesario escribir la expresión de velocidad de las etapas individuales sobre la misma base (por unidad de superficie de partícula, por unidad de volumen de celdas, etc.) y poner todas las etapas (transferencia de masa y reacción) en la misma expresión y combinarlas.
- 2. REACCIONES CATALIZADAS POR SOLIDOS Catalizador: material que afecta la velocidad de reacción, puede aumentarla o disminuirla, no es ni reactivo ni producto de la reacción. Pueden trabajar a temperaturas cercanas a la del ambiente (catalizadores bioquímicos o enzimas) o a temperaturas muy altas (catalizadores creados por el hombre). Una característica muy importante de los catalizadores es su selectividad, un catalizador solo afectara la velocidad de una reacción especifica sin afectar a otras. ¿Qué más debo saber sobre catalizadores? 1.- No se conoce bien el modo de seleccionar un catalizador, es necesario hacer una amplia serie de pruebas antes de lograr un catalizador satisfactorio.
- 3. REACCIONES CATALIZADAS POR SOLIDOS 2.- La simple reproducción de la constitución química no garantiza que el sólido obtenido tenga actividad catalítica, la actividad de un catalizador viene dada por su estructura física. Al calentar un catalizador por encima de su temperatura critica este puede perder su actividad, incluso permanentemente. La investigación actual se enfoca en la estructura de la superficie de los sólidos. 3.- Para explicar la acción de los catalizadores se consideran tres teorías: • El producto intermedio es visto como la asociación de una molécula de reactivo con una región de la superficie, las moléculas están ligadas a la superficie. • Las moléculas se mueven a la atmosfera cercana a la superficie, aun son móviles, aunque están modificadas por las fuerzas de superficie. • Se forma un complejo activo, un radical libre, en la superficie del catalizador, e cual se mueve hacia el cuerpo principal de la corriente de fluido, provocando una cadena de reacciones con nuevas moléculas antes de ser destruido. En las primeras dos teorías se considera que la reacción sucede en la superficie del catalizador, en la tercera supone que la reacción sucede en cuerpo principal del fluido.
- 4. REACCIONES CATALIZADAS POR SOLIDOS 4.- De acuerdo con la teoría del estado de transición, el catalizador reduce la barrera de energía potencial que los reactivos han de salvar para formar productos. 5.- El catalizador no influye en el equilibrio de una reacción, la constante de equilibrio para una reacción es siempre la misma con o sin catalizador. 6.- La superficie sólida es la responsable de la actividad catalítica, los catalizadores deben ser materiales fáciles de manejar y tener una gran superficie fácilmente accesible.
- 5. REACCIONES CATALIZADAS POR SOLIDOS EL ESPECTRO DE REGIMENES CINETICOS: Cuando se tiene una reacción en la que interviene un catalizador de partículas porosas, la velocidad de reacción puede depender de: 1.- La cinética de superficie, la adsorción del reactivo, la reacción y la desorción del producto hacia la corriente de fluido. 2.- La resistencia a la difusión en los poros, lo que podría ocasionar que los reactivos no lleguen al interior de la partícula de catalizador. 3.- El gradiente de temperatura dentro de la partícula, por el calor producido o adsorbido durante la reacción. 4.- El gradiente de temperatura de la película entre la superficie exterior del catalizador y la corriente de fluido.
- 6. REACCIONES CATALIZADAS POR SOLIDOS En sistemas líquidos, el orden en que aparecen los factores es 1,2,5 y raramente 3 y/o 4. Estos son todos los fenómenos que afectan la velocidad de reacción en el mundo real, pero en la mayor parte de las situaciones con catalizadores sólidos, solo se consideran los factores 1 y 2 para el diseño del reactor. 5.- La resistencia a la difusión en la película o gradiente de concentración a través de la película gaseosa que rodea la partícula. IMPORTANTE: Para sistemas gas/catalizador poroso, las reacciones lentas son afectadas únicamente por 1, en reacciones más rápidas se presenta 2 para disminuir la velocidad de reacción y después 3 y/o 4, es improbable que 5 limite la velocidad global.
- 7. REACCIONES CATALIZADAS POR SOLIDOS ECUACIÓN DE VELOCIDAD PARA LA CINÉTICA DE SUPERFICIE La teoría más útil para desarrollar ecuaciones cinéticas fundaméntelas es la que supone que la reacción se efectúa en un sitio activo de la superficie del catalizador. Esta teoría supone tres estepas sucesivas en la superficie: Etapa 1.- Se adsorbe una molécula en la superficie y queda ligada a un sitio activo. Etapa 2.- La molécula reacciona de la siguiente forma: • Con otra molécula localizada en un sitio adyacente (mecanismo de so sitios) • Con una molécula procedente de la corriente principal de fluido o se descompone mientras está ligada al sitio (mecanismo de un solo sitio). Etapa 3.- Los productos se desorben de la superficie, dejando libre el sitio activo.
- 8. REACCIONES CATALIZADAS POR SOLIDOS Las expresiones de velocidad deducidas a partir de los distintos mecanismos postulados tienen la forma: Por ejemplo, para la reacción que ocurre en presencia de un material portador inerte U Cuanto la etapa controlante es la adsorción de A: Cuando la reacción entre A y B unidas a sitios activos adyacentes es que controla la velocidad de reacción:
- 9. REACCIONES CATALIZADAS POR SOLIDOS Cuanto la etapa controlante es la desorción de R: A B S R Cada mecanismo de reacción detallado con su factor controlante tiene su ecuación de velocidad correspondiente, la cual incluirá de tres a siete contrastantes, los valores de K.
- 10. REACCIONES CATALIZADAS POR SOLIDOS La mayoría de los datos de conversión catalítica pueden ajustarse adecuadamente, en función del tiempo de contacto o del espacio-tiempo, mediante expresiones de velocidad relativamente más sencillas, de primer orden o de orden n. Pueden utilizarse ecuaciones de velocidad empíricas sencillas, pero debe considerarse lo siguiente: • Probabilidad de hacer predicciones de la realidad. Si se encuentra un mecanismo complejo que represente lo que realmente ocurre, se puede extrapolar con mayor seguridad a condiciones de operación nuevas. • Problemas para encontrar el mecanismo perfecto. Pueden existir muchos mecanismos que ajusten a una reacción especifica, probarlos todos para demostrar a cabalidad que se ha descubierto el correcto implica diseños experimentales muy extensos, los cuales tomara tiempo y recursos desarrollar.
- 11. REACCIONES CATALIZADAS POR SOLIDOS Para un poro único cilíndrico, reacción de primer orden Se tiene un solo poro cilíndrico de longitud L, con un reactivo A que se difunde hacia el interior del poro y que reacciona en la superficie según la cinética de primer orden que se lleva a cabo en las paredes del poro, y un producto que se difunde hacia afuera del poro. En estado estacionario un balance de materia para el reactivo A sería: RESISTENCIA A LA DIFUSIÓN DE POROS COMBINADA CON LA CINETICA DE SUPERFICIE
- 12. REACCIONES CATALIZADAS POR SOLIDOS Sustituyendo las cantidades especificas: RESISTENCIA A LA DIFUSIÓN DE POROS COMBINADA CON LA CINETICA DE SUPERFICIE Coeficiente de difusión molecular, cm3/s Si se define el límite cuando Δx tiende a cero La reacción química de primer orden se expresa en términos del área en unidad de superficie de la pared del poro, k” tendrá unidades de longitud/tiempo.
- 13. REACCIONES CATALIZADAS POR SOLIDOS La interrelación entre las constantes de velocidad sobre diferentes bases está dada por: Para un poro cilíndrico de catalizador: En términos de unidades de volumen: Si se resuelve la ecuación diferencial: RESISTENCIA A LA DIFUSIÓN DE POROS COMBINADA CON LA CINETICA DE SUPERFICIE M1 y M2 son constantes, las cuales restringen la solución del problema, especificando las particularidades del modelo, se conocen como condiciones frontera.
- 14. A la entrada del poro No hay flujo ni movimiento de compuestos atreves del extremo interior del poro REACCIONES CATALIZADAS POR SOLIDOS Como se van a evaluar dos contantes, es necesario encontrar y especificar dos condiciones frontera. Examinando los límites físicos del poro conceptual, se hacen las siguientes afirmaciones: Entonces: El gradiente (cambio) en la concentración del reactivo dentro del poro esta dado por: RESISTENCIA A LA DIFUSIÓN DE POROS COMBINADA CON LA CINETICA DE SUPERFICIE
- 15. REACCIONES CATALIZADAS POR SOLIDOS RESISTENCIA A LA DIFUSIÓN DE POROS COMBINADA CON LA CINETICA DE SUPERFICIE El factor de eficiencia del catalizador permite medir la disminución de la velocidad de reacción a causa de la resistencia a la difusión del poro. Para reacciones de primer orden, ya que la velocidad es proporcional a la concentración:
- 16. REACCIONES CATALIZADAS POR SOLIDOS RESISTENCIA A LA DIFUSIÓN DE POROS COMBINADA CON LA CINETICA DE SUPERFICIE • Para valores pequeños de mL (mL<0.4), E =1, la concentración del reactivo no desciende apreciablemente dentro del poro. • Para valores grandes de mL (mL > 4), E < 1/mL, la concentración del reactivo desciende rápidamente hasta cero al desplazarse hacia dentro del poro, la difusión tiene una gran influencia sobre la velocidad de reacción, resistencia fuerte en el poro.
- 17. REACCIONES CATALIZADAS POR SOLIDOS DIFERENTES PARTICULAS POROSAS DE CATALIZADOR Lo que se ha definido para un solo poro puede aproximarse al comportamiento de partículas de distintas formas, aplicando lo siguiente: 1.- Uso del coeficiente de difusión apropiado. El coeficiente de difusión molecular se sustituye por el coeficiente de difusión efectiva del fluido en la estructura del sólido. (Weisz) 2.- Medida correcta del tamaño de la partícula. Para encontrar la distancia efectiva a la que se introduce el fluido para cubrir todas las superficies internas, se define un tamaño de partícula característico.
- 18. REACCIONES CATALIZADAS POR SOLIDOS DIFERENTES PARTICULAS POROSAS DE CATALIZADOR 3.- Medidas de la velocidad de reacción. Cinética de primer orden
- 19. REACCIONES CATALIZADAS POR SOLIDOS DIFERENTES PARTICULAS POROSAS DE CATALIZADOR 3.- Medidas de la velocidad de reacción. Cinética de orden n
- 20. REACCIONES CATALIZADAS POR SOLIDOS DIFERENTES PARTICULAS POROSAS DE CATALIZADOR 4.- Thiele y Aris relacionaron E con MT para diferentes formas de partícula de la siguiente forma: 5.- Encontrar los efectos de la resistencia en los poros a partir de experimentos. Modulo de Wagner-Weisz-Wheeler
- 21. REACCIONES CATALIZADAS POR SOLIDOS DIFERENTES PARTICULAS POROSAS DE CATALIZADOR 6.- Limites de la resistencia en los poros. • Cuando el reactivo entra por completo en la partícula y baña toda su superficie, está en el régimen independiente de la difusión. MT < 0.4 o MW < 0.15. • Cuando el centro de la partícula no tiene reactivo, no se utiliza, la partícula se halla en el régimen de poro con fuerte resistencia la difusión. MT > 4 o MW > 4. 7.- Partículas de diferente tamaño. Para partículas de diferente tamaño R1 y R2. La velocidad varia inversamente proporcional al tamaño de la partícula. Régimen independiente de la difusión Régimen con fuerte resistencia a la difusión en los poros 389
- 22. REACCIONES CATALIZADAS POR SOLIDOS Para operaciones lo más eficientes posibles conviene utilizar el tamaño de partícula más grande que todavía no presente resistencia a la difusión de poros: Para reacciones de primer orden en la superficie: RESISTENCIA A LA DIFUSIÓN EN LOS POROS
- 23. REACCIONES CATALIZADAS POR SOLIDOS EFECTOS CALORÍFICOS DURANTE LA REACCIÓN: En condiciones no isotérmicas se pueden presentar dos tipos de efectos de la temperatura: • ΔT dentro de la partícula, podría a ver una variación de la temperatura en el interior de la pastilla de catalizador. • ΔT en la película, la pastilla podría estar a mayor (o menor) temperatura que el fluido que la rodea. En las reacciones exotérmicas las partículas están más calientes que el fluido de los alrededores, la velocidad en estas condiciones no isotérmicas es siempre mayor que la velocidad en condiciones isotérmicas. Se debe favorecer el comportamiento no isotérmico en este tipo de reacciones, siempre que no se presente a temperaturas elevadas el shock térmico, la sinterización de la superficie del catalizador o la disminución de la selectividad. Para reacciones endotérmicas la velocidad en condiciones no isotérmicas es menor que la velocidad en condiciones isotérmicas, la partícula esta menos caliente que el fluido que la rodea. En este tipo de reacciones se debe evitar el comportamiento no isotérmico.
- 24. REACCIONES CATALIZADAS POR SOLIDOS EFECTOS CALORÍFICOS DURANTE LA REACCIÓN: Para encontrar el ΔT en la película se tiene: Longitud característica de la partícula. Para encontrar el ΔT dentro de la partícula (análisis por Prater para cualquier geometría y cinética), las distribuciones de temperatura y concentración deben tener la misma forma: Y para la pastilla como un todo: Conductividad térmica efectiva.
- 25. REACCIONES CATALIZADAS POR SOLIDOS ECUACIONES DE DISEÑO PARA REACTORES QUE CONTIENE PARTICULAS POROSAS DE CATALIZADOR: Para un reactor FLUJO PISTON: Un balance de materia para el reactivo A: En forma diferencial: Integrando a lo largo del todo el reactor: Peso- tiempo volumen-tiempo
- 26. REACCIONES CATALIZADAS POR SOLIDOS ECUACIONES DE DISEÑO PARA REACTORES QUE CONTIENE PARTICULAS POROSAS DE CATALIZADOR: Para un reactor FLUJO PISTON: Para reacciones catalíticas de primer orden:
- 27. REACCIONES CATALIZADAS POR SOLIDOS ECUACIONES DE DISEÑO PARA REACTORES QUE CONTIENE PARTICULAS POROSAS DE CATALIZADOR: Para un reactor DE TANQUE AGITADO: Para un reactor que contiene una carga de catalizador y una carga de gas:
- 28. REACCIONES CATALIZADAS POR SOLIDOS ECUACIONES DE DISEÑO PARA REACTORES QUE CONTIENE PARTICULAS POROSAS DE CATALIZADOR: Aplicación de las ecuaciones de diseño simples. Para reactores donde la fracción de sólido varía con la altura en el reactor, las ecuaciones de diseño don más útiles si se escriben en forma diferencial. El balance de materia sería: f = Fracción de solidos
- 29. REACCIONES CATALIZADAS POR SOLIDOS ECUACIONES DE DISEÑO PARA REACTORES QUE CONTIENE PARTICULAS POROSAS DE CATALIZADOR: Aplicación de las ecuaciones de diseño simples. Del balance de materia se tiene: En forma diferencial: u0 = velocidad de gas superficial (velocidad del gas sin solidos) Integrado:
- 30. REACCIONES CATALIZADAS POR SOLIDOS ECUACIONES DE DISEÑO PARA REACTORES QUE CONTIENE PARTICULAS POROSAS DE CATALIZADOR: Aplicación de las ecuaciones de diseño simples. Para reacciones de primer orden: Para el caso donde Ɛ = 0, f es constante y la altura del lecho de catalizados es H:
- 31. REACCIONES CATALIZADAS POR SOLIDOS METODOS EXPERIMENTALES PARA MEDIR VELOCIDADES Para explorar la cinética de las reacciones catalíticas puede utilizarse cualquier tipo de reactor, se requiere conocer el esquema de contacto, se puede utilizar cualquier patrón de flujo, si no se conoce el patrón de flujo no se puede deducir la cinética. Se debe asegurar de que la ecuación de diseño utilizada sea dimensionalmente correcta. La estrategia experimental utilizada consiste en medir el grado de conversión del fluido que pasa con flujo constante a través de un lecho de sólidos. Reactor diferencial. Se considera que la velocidad de reacción es constante en todos los puntos del reactor, esta suposición aplica solo para conversiones pequeñas o en reactores pequeños y poco profundos, para reactores grandes donde se desarrollan reacciones lentas o de orden cero. La ecuación de diseño es:
- 32. REACCIONES CATALIZADAS POR SOLIDOS METODOS EXPERIMENTALES PARA MEDIR VELOCIDADES EJEMPLO: ECUACIÓN CINETICA DEDUCIDA A PARTIR DE UN REACTOR DIFERENCIAL La reacción catalítica A→ 4R se lleva a cabo a 3.2 atm y 117 °C en un reactor de flujo pistos que contiene 0.01 kg de catalizador y emplea una alimentación formada por un producto parcialmente vertido de 20 litros/hora de A puro sin reaccional. A partir de los siguientes datos, encontrar la ecuación de velocidad : Ec. De diseño para un reactor diferencial.
- 33. REACCIONES CATALIZADAS POR SOLIDOS METODOS EXPERIMENTALES PARA MEDIR VELOCIDADES EJEMPLO: ECUACIÓN CINETICA DEDUCIDA A PARTIR DE UN REACTOR DIFERENCIAL
- 34. REACCIONES CATALIZADAS POR SOLIDOS METODOS EXPERIMENTALES PARA MEDIR VELOCIDADES Reactor Integral. Cuando la variación de la velocidad de reacción dentro del reactor es muy grande, la composición del fluido reactivo cambia significativamente al pasar por el rector. Para la búsqueda de una ecuación de velocidad se tienen dos procedimientos: Análisis Integral. Es un procedimiento rápido y directo para comprobar expresiones sencillas de velocidad. Un mecanismo especifico con una ecuación cinética se pone a prueba por integración de la ecuación básica de diseño. Análisis diferencial. Este método es adecuado para ecuaciones de velocidad más complicadas, diferenciando la ecuación de diseño se tiene:
- 35. REACCIONES CATALIZADAS POR SOLIDOS METODOS EXPERIMENTALES PARA MEDIR VELOCIDADES EJEMPLO 2: ECUACIÓN CINETICA DEDUCIDA A PARTIR DE UN REACTOR INTEGRAL La reacción catalítica A→ 4R se estudia en un reactor de flujo pistón empleando distintas cantidades de catalizador y una alimentación de 20 litros/h de A puro a 3.2 atm y 117 °C. Las concentraciones de A en la corriente de salida para los distintos experimentos son las siguientes: a) Encontrar la ecuación cinética de esta reacción empleando el método integral de análisis.
- 36. REACCIONES CATALIZADAS POR SOLIDOS METODOS EXPERIMENTALES PARA MEDIR VELOCIDADES EJEMPLO 2: ECUACIÓN CINETICA DEDUCIDA A PARTIR DE UN REACTOR INTEGRAL Se supone una cinética de primer orden, y tenemos que: Ecuación con forma y = c X, donde c es una constante de proporcionalidad (pendiente de la recta.
- 37. REACCIONES CATALIZADAS POR SOLIDOS METODOS EXPERIMENTALES PARA MEDIR VELOCIDADES EJEMPLO 2: ECUACIÓN CINETICA DEDUCIDA A PARTIR DE UN REACTOR INTEGRAL
- 38. REACCIONES CATALIZADAS POR SOLIDOS METODOS EXPERIMENTALES PARA MEDIR VELOCIDADES EJEMPLO 2: ECUACIÓN CINETICA DEDUCIDA A PARTIR DE UN REACTOR INTEGRAL EJEMPLO 2: ECUACIÓN CINETICA DEDUCIDA A PARTIR DE UN REACTOR INTEGRAL La reacción catalítica A→ 4R se estudia en un reactor de flujo pistón empleando distintas cantidades de catalizador y una alimentación de 20 litros/h de A puro a 3.2 atm y 117 °C. Las concentraciones de A en la corriente de salida para los distintos experimentos son las siguientes: b) Repetir el inciso a empleando el método diferencial de análisis.
- 39. REACCIONES CATALIZADAS POR SOLIDOS METODOS EXPERIMENTALES PARA MEDIR VELOCIDADES EJEMPLO 2: ECUACIÓN CINETICA DEDUCIDA A PARTIR DE UN REACTOR INTEGRAL La velocidad de reacción está dada por la pendiente de la curva XA contra W/F.
- 40. REACCIONES CATALIZADAS POR SOLIDOS METODOS EXPERIMENTALES PARA MEDIR VELOCIDADES EJEMPLO 2: ECUACIÓN CINETICA DEDUCIDA A PARTIR DE UN REACTOR INTEGRAL La velocidad de reacción está dada por la pendiente de la curva XA contra W/F. -rA = 116.1 (litros/h Kg cat) CA (mol/L)
- 41. REACCIONES CATALIZADAS POR SOLIDOS METODOS EXPERIMENTALES PARA MEDIR VELOCIDADES EJEMPLO 3: TAMAÑO DEL REACTOR DE FLUJO PISTON A PARTIR DE UNA ECUACIÓN CINETICA Considere la reacción catalítica del ejemplo anterior. Partiendo de la ecuación cinética encontrada para esta reacción, calcular la cantidad de catalizador que necesita el lector de lecho empacado (suponer flujo pistón) para una conversión de 35% de A en R para una alimentación de 2000 mol/h de A puro a 3.2 atm y 117°C. Ecuaciones para primer orden en reactor flujo pistón.
- 42. REACCIONES CATALIZADAS POR SOLIDOS METODOS EXPERIMENTALES PARA MEDIR VELOCIDADES EJEMPLO 4: TAMAÑO DEL REACTOR DE TANQUE AGITADO A PARTIR DE UNA ECUACIÓN CINETICA Considere la reacción catalítica del ejemplo anterior. Partiendo de la ecuación cinética encontrada para esta reacción, calcular la cantidad de catalizador necesario en un reactor de lector empacado con una relación de recirculación muy grande (suponer tanque agitado) para una conversión de 35% de A en R y con una velocidad de alimentación de 2000 mol/h de A puro a 3.2 atm y 117°C. Ecuaciones para primer orden en reactor de tanque agitado. Un reactor de tanque agitado necesita más catalizador que uno de flujo pistón. Tanque agitado
- 43. REACCIONES CATALIZADAS POR SOLIDOS METODOS EXPERIMENTALES PARA MEDIR VELOCIDADES EJEMPLO 5: TAMAÑO DEL REACTOR DE FLUJO PISTON A PARTIR A PARTIR DE DATOS DE CONCENTRACIÓN Y VELOCIDAD DE REACCIÓN Considere la reacción catalítica del ejemplo1, suponer que se dispone de los siguientes datos de concentración velocidad de reacción: Encontrar el tamaño del lecho empacado que se necesita para tratar una alimentación de 2000 mol/h de A puro a 117°C ( CA =0.1 mol/litro y Ɛ = 3) para 35% de conversión, a 3.2 atm. Ecuación de diseño para un reactor de flujo pistón. Se realizará una integración grafica de la ecuación, usando los datos proporcionados.
- 44. REACCIONES CATALIZADAS POR SOLIDOS METODOS EXPERIMENTALES PARA MEDIR VELOCIDADES EJEMPLO 5: TAMAÑO DEL REACTOR DE FLUJO PISTON A PARTIR A PARTIR DE DATOS DE CONCENTRACIÓN Y VELOCIDAD DE REACCIÓN Se realizará una integración grafica de la ecuación, usando los datos proporcionados.
- 45. REACCIONES CATALIZADAS POR SOLIDOS METODOS EXPERIMENTALES PARA MEDIR VELOCIDADES EJEMPLO 5: TAMAÑO DEL REACTOR DE FLUJO PISTON A PARTIR A PARTIR DE DATOS DE CONCENTRACIÓN Y VELOCIDAD DE REACCIÓN Se realizará una integración grafica de la ecuación, usando los datos proporcionados.