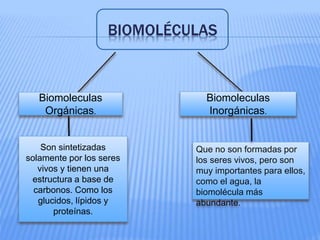
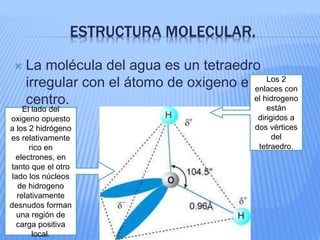
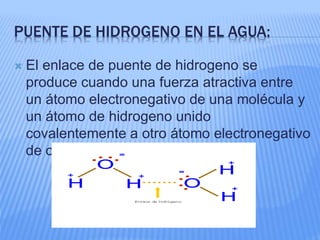
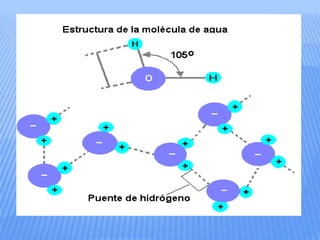
El documento proporciona información sobre la bioquímica. Explica que la bioquímica estudia las sustancias y reacciones químicas en los organismos vivos. También describe las principales biomoléculas como carbohidratos, lípidos, proteínas y ácidos nucleicos. Finalmente, señala que el agua es una biomolécula esencial para los procesos metabólicos en los seres vivos.