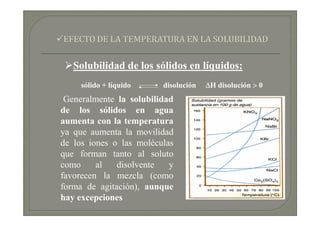
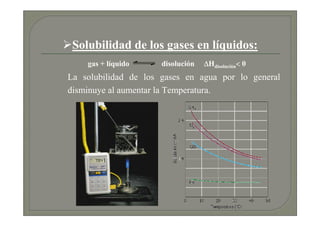
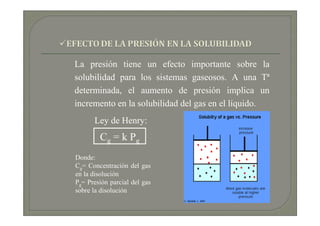
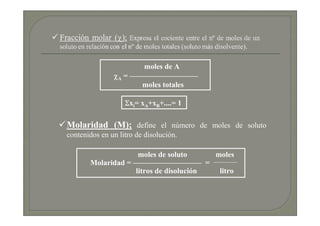
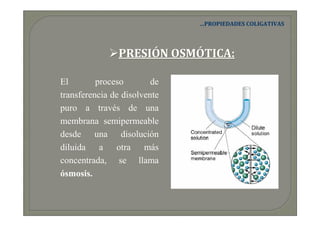
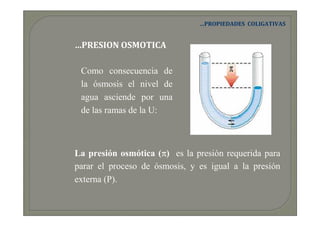
Este documento trata sobre química médica. Explica conceptos básicos sobre disoluciones como los componentes de una disolución (soluto y disolvente), tipos de disoluciones según sus componentes y estado, y factores que afectan la solubilidad como la temperatura y presión. También describe propiedades coligativas de las disoluciones como la disminución de la presión de vapor, aumento de la temperatura de ebullición y disminución de la temperatura de congelación.

![Ejemplos:
•Disolución de glucosa(s) en H2O(l): glucosa(ac);
C6H12O6(ac)
•Disolución de metanol(l) en H2O(l): metanol(ac);
CH3OH(ac)
•Disolución de O2(g) en H2O(l): [respiración de peces]
•Disolución acuosa de NaCl, KCl, CaCl2 y C6H12O6:
[un suero fisiológico]](https://image.slidesharecdn.com/soluciones-120525205036-phpapp01/85/Soluciones-3-320.jpg)