Determinar pKa laboratorio
- 1. PRÁCTICA DE LABORATORIO DE QUÍMICA FÍSICA triplenlace.com
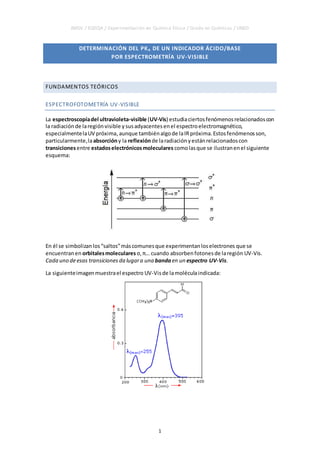
- 2. Esta presentación contiene explicaciones para determinar en el laboratorio el pKa de un indicador acido-base que es un ácido orgánico débil. triplenlace.com
- 4. Azul de bromofenol (3',3'',5',5''-tetrabromofenolsulfonefthaleína) Por ejemplo, el azul de bromofenol… triplenlace.com
- 5. Azul de bromofenol (3',3'',5',5''-tetrabromofenolsulfonefthaleína) que cambia de color entre pH 3 y pH 4,6, aproximadamente… triplenlace.com
- 6. Azul de bromofenol (3',3'',5',5''-tetrabromofenolsulfonefthaleína) pH = 3 pH = 4,6 es un ácido orgánico débil que en disolución está en equilibrio entre estas dos formas: triplenlace.com
- 7. Azul de bromofenol (3',3'',5',5''-tetrabromofenolsulfonefthaleína) pH = 3 pH = 4,6 Nota: todas las formas del azul de bromofenol a distintos pH pueden verse aquí: https://triplenlace.com/2013/12/15/azul-de- bromofenol-amarillo-verde-azul-e-incoloro/ triplenlace.com
- 8. Equilibrio químico de un indicador ácido orgánico HA HA + H2O ⇌ A- + H3O+ Consideremos el siguiente… triplenlace.com
- 9. Equilibrio químico de un indicador ácido orgánico HA Un color Otro color HA + H2O ⇌ A- + H3O+ Ambas especies, HA y A-, tienen diferentes colores (si no fuera así, la sustancia no serviría de indicador) triplenlace.com
- 10. HA + H2O ⇌ A- + H3O+ Vamos a considerar cómo se afecta el equilibrio de un indicador en disolución cuando se añade a la misma: 1º) un ácido 2º) una base triplenlace.com
- 11. HA + H2O ⇌ A- + H3O+ Si se añade un ácido fuerte se aportan H3O+ triplenlace.com
- 12. HA + H2O ⇌ A- + H3O+ Que reaccionan con A- desplazando el equilibrio hacia la izquierda triplenlace.com
- 13. HA + H2O ⇌ A- + H3O+ Que reaccionan con A- desplazando el equilibrio hacia la izquierda triplenlace.com
- 14. HA + H2O ⇌ A- + H3O+ De modo que si la cantidad de ácido añadido es suficientemente grande, solo habrá HA, no A- triplenlace.com
- 15. HA + H2O ⇌ A- + H3O+ Si se añade un hidróxido, los OH- reaccionan con los H3O+… Por el contrario, si se añade una base triplenlace.com
- 16. HA + H2O ⇌ A- + H3O+ Al disminuir [H3O+], el equilibrio se desplazará a la derecha (por el principio de Le Châtelier ) triplenlace.com
- 17. HA + H2O ⇌ A- + H3O+ Así que, si se añade suficiente cantidad de base, solo quedará A- y nada de HA triplenlace.com
- 18. Supongamos que, cuando se ha añadido suficiente ácido externo a una disolución acuosa del indicador HA como para que el pH de la disolución sea 1, todo el indicador está en la forma HA (nota: los valores de pH que vamos a ir considerando en la argumentación que sigue son arbitrarios, ya que dependen de cada indicador) HA pH = 1 triplenlace.com
- 19. HA pH = 1 Si registramos en ese momento el espectro visible de la disolución, la banda o bandas que se observen corresponderán exclusivamente a la especie HA Longitud de onda / nm Absorbancia triplenlace.com
- 20. HA pH = 1 [Obsérvese que la especie HA del indicador concreto que estamos tomando como ejemplo absorbe en la zona del añil. Por lo tanto, su color será rojizo, ya que el color que se observa es el complementario del que se absorbe] Longitud de onda / nm Absorbancia triplenlace.com
- 21. A- pH = 13 Longitud de onda / nm Absorbancia HA pH = 1 Supongamos ahora que añadimos suficiente base como para que todo el indicador esté en la forma A- y que el espectro que se obtiene es el de la figura. Lógicamente, ese será el espectro de la forma A- de la sustancia, ya que no hay nada de la otra forma, HA. triplenlace.com
- 22. A- pH = 13 Longitud de onda / nm Absorbancia HA pH = 1 [Nótese que la especie A- del indicador que estamos considerando absorbe mayoritariamente en la región del amarillo al rojo. Por lo tanto, su color será azulado] triplenlace.com
- 23. HA + A- pH = 4 A- pH = 13 HA pH = 1 Si el pH es tal que, aunque predomine la forma ácida, HA, también exista un poco de la básica, A-… triplenlace.com
- 24. HA + A- pH = 4 Longitud de onda / nm Absorbancia A- pH = 13 HA pH = 1 … el espectro obtenido será la suma de ambas contribuciones triplenlace.com
- 25. HA + A- pH = 4 Longitud de onda / nm Absorbancia A- pH = 13 HA pH = 1 Esta banda corresponde a la forma ácida, HA, que es la mayoritaria Y esta a la forma básica, A-, que por ser minoritaria a ese pH tiene una absorbancia muy baja triplenlace.com
- 26. HA + A- pH = 7 Longitud de onda / nm Absorbancia A- pH = 13 HA + A- pH = 4 HA pH = 1 Conforme vayamos aumentando el pH irá disminuyendo la proporción de HA y aumentando la de A-, y eso se reflejará en el espectro Conforme vayamos aumentando el pH, irá disminuyendo la proporción de HA y aumentando la de A-, y eso se reflejará en el espectro triplenlace.com
- 27. HA + A- pH = 10 Longitud de onda / nm Absorbancia A- pH = 13 HA + A- pH = 7 HA + A- pH = 4 HA pH = 1 triplenlace.com
- 28. Longitud de onda / nm Absorbancia HA + A- pH = 10 A- pH = 13 HA + A- pH = 7 HA + A- pH = 4 HA pH = 1 pH = 2 pH = 3 pH = 5 pH = 7 pH = 9 pH = 10 pH = 12 pH = 13Estos serían los cinco espectros superpuestos (y algunos más a otros pH) pH = 1 triplenlace.com
- 29. Longitud de onda / nm Absorbancia HA + A- pH = 10 A- pH = 13 HA + A- pH = 7 HA + A- pH = 4 HA pH = 1 Este valor de longitud de onda se llama punto isosbéstico y suele aparecer en sistemas en los que existe un equilibrios químicos (en este caso, entre HA y A-). [Su significado se explica aquí: http://triplenlace.com/2013/11/29/que-es-un-punto- isosbestico-en-espectroscopia-y-que-revela/ ] triplenlace.com
- 30. HA + H2O ⇌ A- + H3O+ Volvamos ahora al equilibrio del indicador en disolución acuosa triplenlace.com
- 31. HA + H2O ⇌ A- + H3O+ Su constante de equilibrio como ácido, Ka, tiene esta expresión: Ka = (aH3O+) (aA-) / aHA) triplenlace.com
- 32. HA + H2O ⇌ A- + H3O+ La podemos escribir de este modo si las concentraciones son bajas (ya que en ese caso se pueden igualar las actividades a concentraciones sin demasiado error) Ka = (aH3O+) (aA-) / aHA) Ka ≅ (aH3O+) (cA-) / cHA) triplenlace.com
- 33. HA + H2O ⇌ A- + H3O+ Tomando logaritmos y recordando las definiciones de pKa ( = –log Ka) y pH ( = –log(aH3O+) se puede llegar a: Ka = (aH3O+) (aA-) / aHA) Ka ≅ (aH3O+) (cA-) / cHA) pKa ≅ pH + log (cHA / cA-) triplenlace.com
- 34. Ka = (aH3O+) (aA-) / aHA) Ka ≅ (aH3O+) (cA-) / cHA) pKa ≅ pH + log (cHA / cA-) log (cA- / cHA) ≅ pH – pKa HA + H2O ⇌ A- + H3O+ Reordenando se llega a esta expresión que liga la relación de concentraciones cA- / cHA con el pH correspondiente (y con el pKa) triplenlace.com
- 35. HA + H2O ⇌ A- + H3O+ log [(cA-)/(cHA)] pH log (cA- / cHA) ≅ pH – pKa Nótese que, según esta ecuación, si representamos los valores de log [(cA-)/(cHA)] de una serie de experimentos a diferentes pH deberíamos obtener una recta triplenlace.com
- 36. HA + H2O ⇌ A- + H3O+ log (cA- / cHA) ≅ pH – pKa La recta debería tener ordenada en el origen –pKa–pKa log [(cA-)/(cHA)] pH triplenlace.com
- 37. HA + H2O ⇌ A- + H3O+ log (cA- / cHA) ≅ pH – pKa Nótese que esta ecuación se puede reordenar cambiando de términos pH y log (cA- / cHA) –pKa log [(cA-)/(cHA)] pH triplenlace.com
- 38. HA + H2O ⇌ A- + H3O+ pH ≅ log (cA- / cHA) + pKa –pKa log [(cA-)/(cHA)] pH Obtendríamos esto triplenlace.com
- 39. HA + H2O ⇌ A- + H3O+ pH ≅ log (cA- / cHA) + pKa pKa pH Si ahora representamos gráficamente pH frente a log (cA- / cHA) debería obtenerse otra recta, esta de ordenada en el origen +pKa triplenlace.com log [(cA-)/(cHA)]
- 40. HA + H2O ⇌ A- + H3O+ pH ≅ log (cA- / cHA) + pKa pKa pH Los valores de pKa obtenidos por ambas vías no suelen coincidir, ya que, como es sabido en estadística, la regresión de datos experimentales y sobre x no suele coincidir con la de los datos x sobre los y. Po ello, lo más prudente es obtener el valor medio triplenlace.com log [(cA-)/(cHA)]
- 41. HA + H2O ⇌ A- + H3O+ En cualquier caso, ¿cómo podemos conocer por espectrofotometría los valores de log [(cA-)/(cHA)] para cada pH? … Lo explicamos a continuación. triplenlace.com pKa pH log [(cA-)/(cHA)]
- 42. HA + H2O ⇌ A- + H3O+ Si llamamos: • AHA a la absorbancia (medida a una longitud de onda λ) del espectro de una disolución de indicador a un pH para el que solo exista la especie HA; triplenlace.com
- 43. HA + H2O ⇌ A- + H3O+ Si llamamos: • AHA a la absorbancia (medida a una longitud de onda λ) del espectro de una disolución de indicador a un pH para el que solo exista la especie HA; • AA- a la absorbancia (a la misma longitud de onda λ) del espectro de una disolución de indicador a un pH para el que solo exista la especie A-; triplenlace.com
- 44. HA + H2O ⇌ A- + H3O+ Si llamamos: • AHA a la absorbancia (medida a una longitud de onda λ) del espectro de una disolución de indicador a un pH para el que solo exista la especie HA; • AA- a la absorbancia (a la misma longitud de onda λ) del espectro de una disolución de indicador a un pH para el que solo exista la especie A-; • Ai a la absorbancia (a la misma longitud de onda λ) del espectro de una disolución de indicador a un pHi para el que solo existan tanto la especie HA como la A-… triplenlace.com
- 45. HA + H2O ⇌ A- + H3O+ (cA-,i)/(cHA,i) = (AHA – Ai) / (Ai – AA-) Si llamamos: • AHA a la absorbancia (medida a una longitud de onda λ) del espectro de una disolución de indicador a un pH para el que solo exista la especie HA; • AA- a la absorbancia (a la misma longitud de onda λ) del espectro de una disolución de indicador a un pH para el que solo exista la especie A-; • Ai a la absorbancia (a la misma longitud de onda λ) del espectro de una disolución de indicador a un pHi para el que solo existan tanto la especie HA como la A-… entonces se puede demostrar que triplenlace.com
- 46. HA + H2O ⇌ A- + H3O+ (cA-,i)/(cHA,i) = (AHA – Ai) / (Ai – AA-) (La demostración está aquí: http://triplenlace.com/2012/12/05/especrofotometria-uv-visible-iii- aplicaciones-en-quimica/ ) Si llamamos: • AHA a la absorbancia (medida a una longitud de onda λ) del espectro de una disolución de indicador a un pH para el que solo exista la especie HA; • AA- a la absorbancia (a la misma longitud de onda λ) del espectro de una disolución de indicador a un pH para el que solo exista la especie A-; • Ai a la absorbancia (a la misma longitud de onda λ) del espectro de una disolución de indicador a un pHi para el que solo existan tanto la especie HA como la A-… entonces se puede demostrar que triplenlace.com
- 47. Procedimiento experimental Veamos cómo se hace esto en el laboratorio triplenlace.com
- 48. Longitud de onda / nm Absorbancia A- pH = 13 HA pH = 1 Obtenemos por separado los espectros de las especies HA y A- (aunque aquí los mostramos superpuestos) triplenlace.com
- 49. Longitud de onda / nm Absorbancia A- pH = 13 HA pH = 1 Anotamos una longitud de onda, λ, para la que se observe gran diferencia de absorbancia entre los espectros de las formas HA y A- (esto es para minimizar errores; nótese que esta λ, la absorbancia de A- es altísima y la de HA es prácticamente nula) λ triplenlace.com
- 50. λ AA- Longitud de onda / nm Absorbancia A- pH = 13 HA pH = 1 Se mide y se anota la absorbancia de A- (AA-) a la longitud de onda elegida triplenlace.com
- 51. λ AA- AHA Longitud de onda / nm Absorbancia A- pH = 13 HA pH = 1 Y se mide y se anota la absorbancia de HA- (AHA) a la misma longitud de onda triplenlace.com
- 52. λ Longitud de onda / nm Absorbancia Después se obtienen los espectros de la disolución a diferentes pHi … triplenlace.com
- 53. λ A1 Longitud de onda / nm Absorbancia Después se obtienen los espectros de la disolución a diferentes pHi … y se miden sus absorbancias Ai a la misma longitud de onda triplenlace.com
- 54. λ A1 A2 Longitud de onda / nm Absorbancia triplenlace.com
- 55. λ A1 A2 A3 Longitud de onda / nm Absorbancia triplenlace.com
- 56. λ A1 A2 A3 A4 Longitud de onda / nm Absorbancia triplenlace.com
- 57. λ A1 A2 A3 A4 A5 Longitud de onda / nm Absorbancia triplenlace.com
- 58. λ A1 A2 A3 A4 A5 A6 Longitud de onda / nm Absorbancia triplenlace.com
- 59. λ A1 A2 A3 A4 A5 A6 A7 Longitud de onda / nm Absorbancia triplenlace.com
- 60. log [(AHA – Ai) / (Ai – AA-)] pHi . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . Finalmente se escriben en una tabla los valores de log [(AHA – Ai) / (Ai – AA-)] para los pHi de las disoluciones… triplenlace.com
- 61. –pKa log [(AHA – Ai) / (Ai – AA-)] pHi . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . y se representan gráficamente, como se ha indicado antes, tanto log [(AHA – Ai) / (Ai – AA-)] frente a pH como al revés log [(AHA – Ai) / (Ai – AA-)] pH triplenlace.com pKa pH log [(AHA – Ai) / (Ai – AA-)]
- 62. –pKa log [(AHA – Ai) / (Ai – AA-)] pHi . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . Se puede dar como valor de pKa la media de los obtenidos (sobre este punto, puede encontrarse una discusión interesante en https://goo.gl/s6YuF3) log [(AHA – Ai) / (Ai – AA-)] pH triplenlace.com pKa pH log [(AHA – Ai) / (Ai – AA-)]
- 63. Preparación de las disoluciones triplenlace.com
- 64. Disoluciones Preparación de las disoluciones triplenlace.com
- 65. Disoluciones • Indicador, conc. aprox. 10-4 M Preparación de las disoluciones triplenlace.com
- 66. Disoluciones • Indicador, conc. aprox. 10-4 M • 50 mL 0,1 M HCl • 50 mL 0,1 M NaOH Preparación de las disoluciones triplenlace.com
- 67. Disoluciones • Indicador, conc. aprox. 10-4 M • 50 mL 0,1 M HCl • 50 mL 0,1 M NaOH • Disoluciones amortiguadoras de pH citrato-fosfato a partir de ácido cítrico (C6H8O7) 0,1 M e hidrogenofosfato sódico (Na2HPO4) 0,2 M Preparación de las disoluciones triplenlace.com
- 68. Disoluciones • Indicador, conc. aprox. 10-4 M • 50 mL 0,1 M HCl • 50 mL 0,1 M NaOH • Disoluciones amortiguadoras de pH citrato-fosfato a partir de ácido cítrico (C6H8O7) 0,1 M e hidrogenofosfato sódico (Na2HPO4) 0,2 M C6H8O7 / mL Na2HPO4 / mL pH aprox. 44,6 5,4 2,6 39,8 10,2 3,0 35,9 14,1 3,4 32,3 17,7 3,8 29,4 20,6 4,2 26,7 23,3 4,6 24,3 25,7 5,0 6,5 43,6 7,0 Preparación de las disoluciones Los pH de los tampones preparados según la receta indicada en la tabla deberían ser aproximadamente estos, pero habría que medirlos con exactitud con un pHmetro triplenlace.com
- 70. 1. a) Preparar unas 8 disoluciones de 50 mL de indicador, cada una de diferente pH. (Para ello, tomar 5 mL de la disolución madre de indicador y diluirlos hasta 50 mL con cada una de los tampones.) (En estas disoluciones se medirán las Ai.) b) Preparar 2 disoluciones más de indicador del mismo modo anterior, pero usando el HCl y el NaOH. (En estas disoluciones se medirán las AHA y AA-.) Pasos a seguir triplenlace.com
- 71. 1. a) Preparar unas 8 disoluciones de 50 mL de indicador, cada una de diferente pH. (Para ello, tomar 5 mL de la disolución madre de indicador y diluirlos hasta 50 mL con cada una de los tampones.) (En estas disoluciones se medirán las Ai.) b) Preparar 2 disoluciones más de indicador del mismo modo anterior, pero usando el HCl y el NaOH. (En estas disoluciones se medirán las AHA y AA-.) Pasos a seguir 2. Registrar los espectros de todas las disoluciones entre 400 y 700 nm y medir las absorbancias a la longitud de onda elegida . Esto proporcionará los valores de las Ai, AHA y AA-. triplenlace.com
- 72. 1. a) Preparar unas 8 disoluciones de 50 mL de indicador, cada una de diferente pH. (Para ello, tomar 5 mL de la disolución madre de indicador y diluirlos hasta 50 mL con cada una de los tampones.) (En estas disoluciones se medirán las Ai.) b) Preparar 2 disoluciones más de indicador del mismo modo anterior, pero usando el HCl y el NaOH. (En estas disoluciones se medirán las AHA y AA-.) 2. Registrar los espectros de todas las disoluciones entre 400 y 700 nm y medir las absorbancias a la longitud de onda elegida . Esto proporcionará los valores de las Ai, AHA y AA-. 3. Tabular log [(AHA – Ai) / (Ai – AA-)] y pHi y representar gráficamente de los dos modos explicados. Pasos a seguir triplenlace.com
- 73. Más información teórica sobre esta práctica en: http://triplenlace.com/2012/12/02/especrofotometra-uv- visible-i-el-color-de-los-objetos/ triplenlace.com
- 74. Prácticas de Química Física https://triplenlace.com/experimentacion-en-quimica-fisica/ Más…