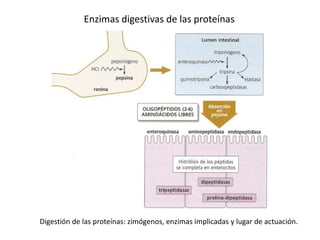
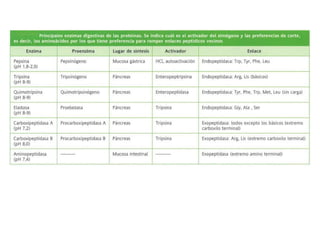
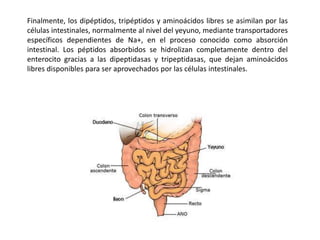
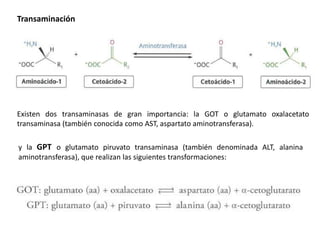
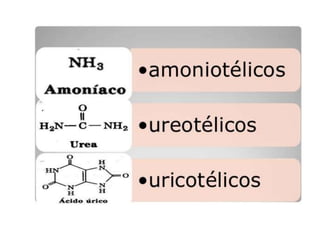
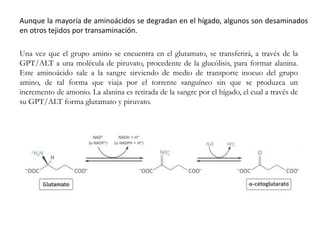
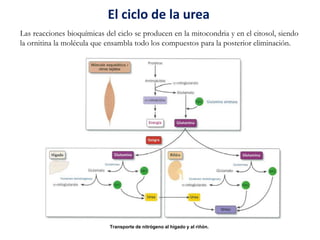
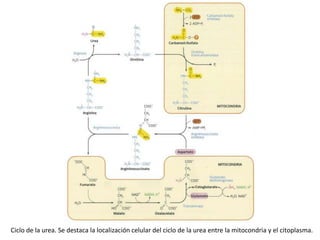
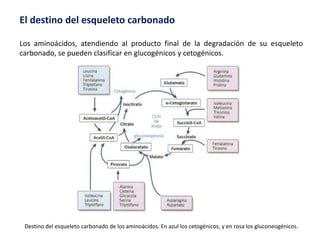
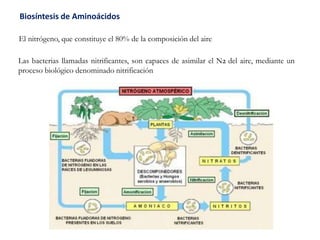
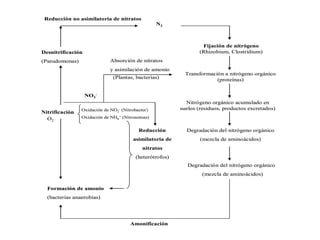
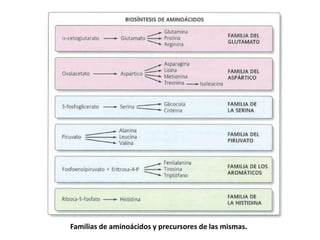
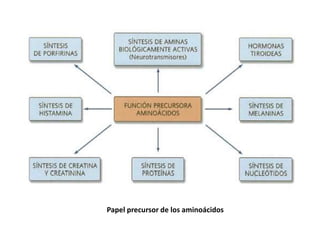
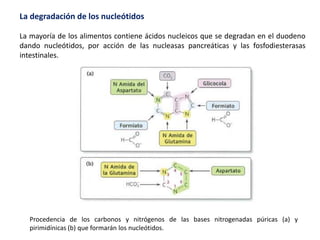
El documento aborda la degradación de aminoácidos y el ciclo de la urea, destacando que el metabolismo de compuestos nitrogenados incluye proteínas, bases nitrogenadas y porfirinas. Se detalla el proceso digestivo y celular para obtener aminoácidos, su recambio proteico y la eliminación del nitrógeno, enfatizando la importancia de la detoxificación del amoníaco. Además, se menciona la biosíntesis de aminoácidos y la degradación de nucleótidos en el sistema digestivo.