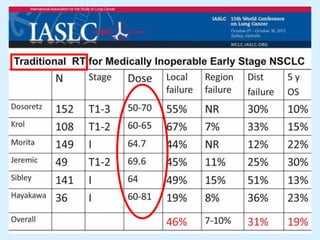
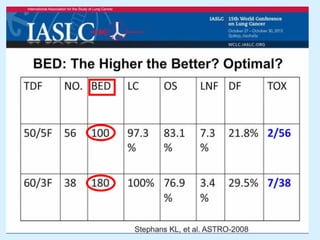
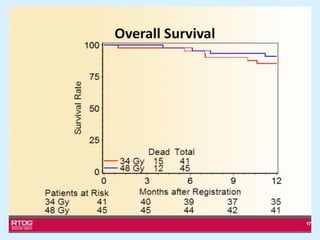
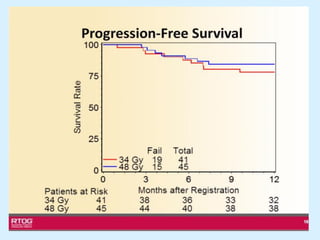
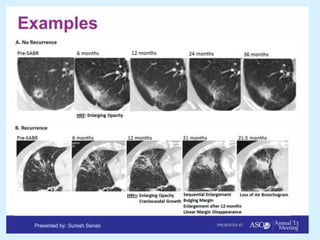
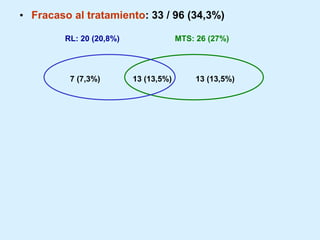
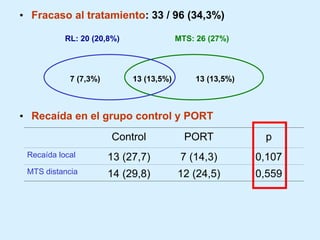
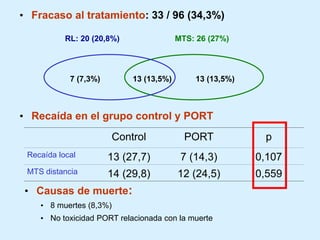
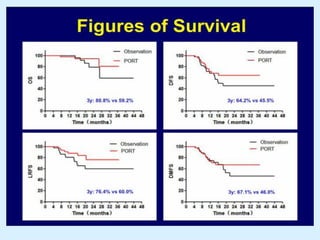
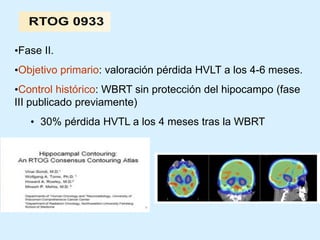
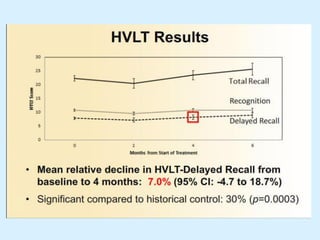
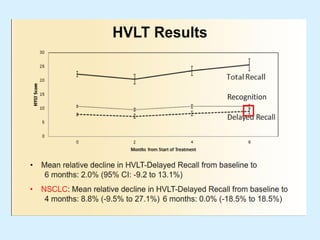
El documento detalla los avances en radioterapia para el tratamiento del cáncer de pulmón, enfocándose en la efectividad de la radioterapia estereotáctica corporal (SBRT) y su dosificación óptima en pacientes no operables. Se presentan estudios que demuestran que una dosis media de 100-112.3 Gy ofrece mejores resultados en supervivencia, mientras que se identifican signos en tomografías que pueden predecir recaídas locales. Además, se discuten aspectos de toxicidad y la importancia de la protección del hipocampo durante la radioterapia craneal para preservar la memoria.