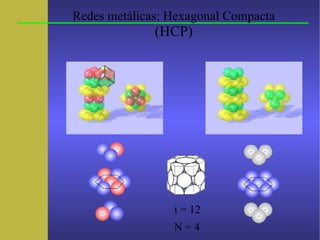
Este documento trata sobre la cristalografía y las propiedades de los átomos y moléculas. Explica que los átomos están formados por protones, neutrones y electrones. Las moléculas son la unidad mínima de materia que conserva las propiedades químicas y están formadas por átomos unidos mediante enlaces químicos. Finalmente, describe las redes cristalográficas como patrones que se repiten en los cristales formados por la ordenación de moléculas.