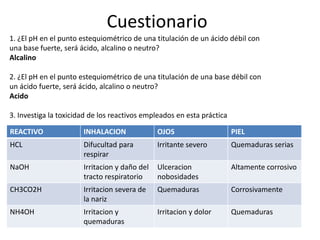
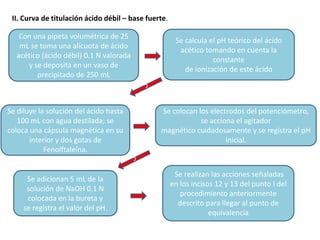
Este documento presenta los procedimientos para realizar curvas de titulación ácido-base utilizando un potenciómetro para medir el pH. Se describen las curvas que resultan de titular un ácido fuerte con una base fuerte, un ácido débil con una base fuerte, y una base débil con un ácido fuerte. El objetivo es observar los cambios de pH durante las titulaciones y comparar las curvas resultantes para ácidos y bases fuertes versus débiles.



![CURVAS DE TITULACIÓN PARA ACIDOS Y BASES FUERTES
En solución acuosa, los ácidos y las bases fuertes se encuentran totalmente
disociados, por lo tanto, el pH a lo largo de la titulación se puede calcular
directamente de las cantidades estequiométricas de ácido y base que van
reaccionando. En el punto de equivalencia el pH está determinado por el grado
de disociación del agua a 25°C, el pH del agua pura es de 7.00
Los iones hidronio en una solución acuosa de un ácido fuerte provienen de dos
fuentes: 1) la reacción del ácido con el agua, y 2) la disociación de ésta. Sin
embargo, en casi todas las soluciones diluidas, la contribución de un ácido fuerte
excede con mucho a la del disolvente. Así para una solución de HCl con una
concentración mayor a 1x10-6 M, se escribe
donde [OH-] representa la contribución de los iones hidronio que provienen de la
disociación del agua. Una relación semejante se aplica a una solución de una
base fuerte como el hidróxido de sodio. Es decir,](https://image.slidesharecdn.com/practica5-131019144152-phpapp01/85/PRACTICA-5-CURVAS-DE-NEUTRALIZACION-4-320.jpg)