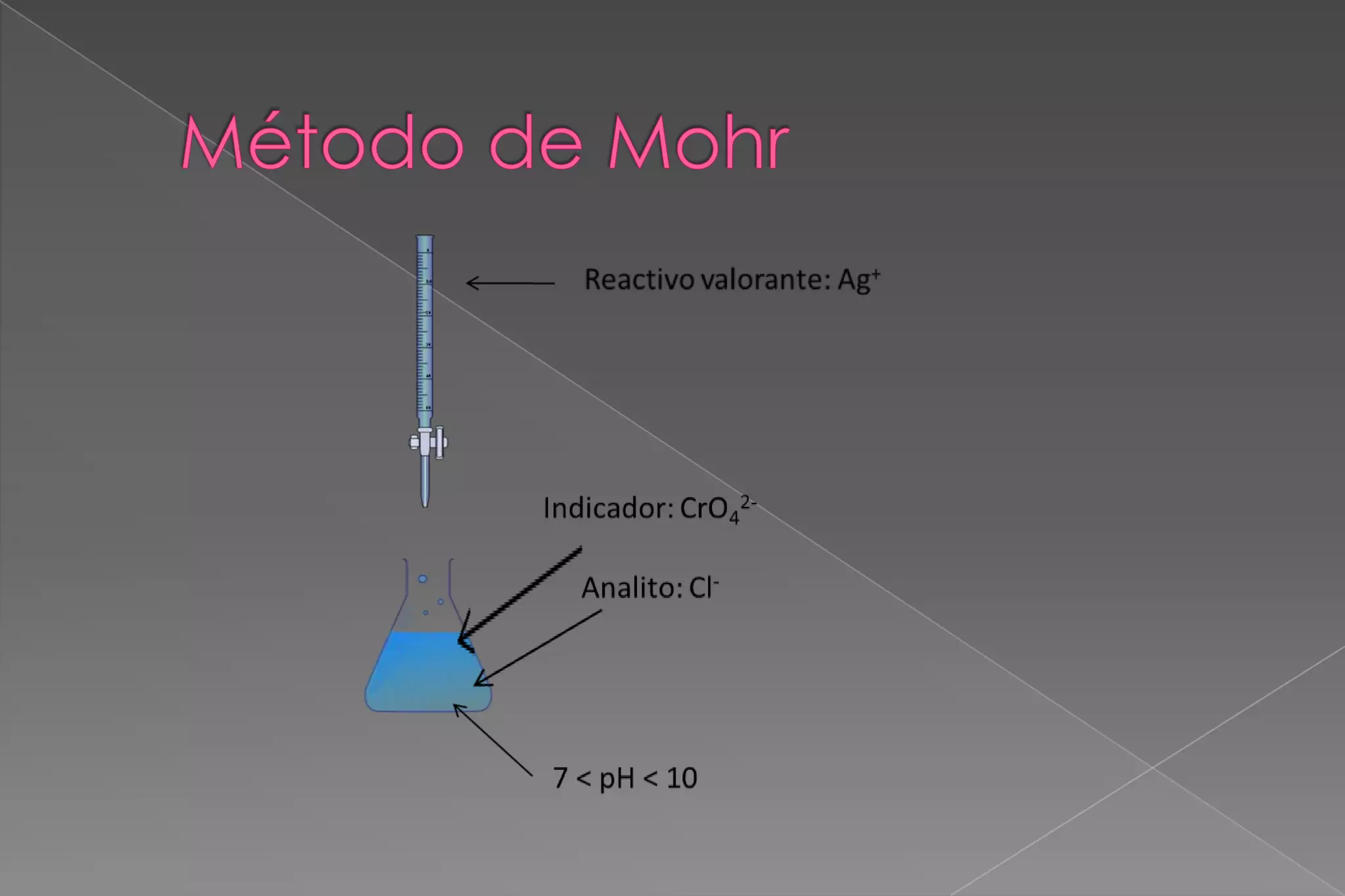
Este documento describe un método volumétrico para determinar analitos como cloruros o bromuros mediante titulación con una solución de nitrato de plata usando cromato de potasio como indicador. El indicador cambia de color a rojo ladrillo cuando se forma el precipitado insoluble de cromato de plata. El método puede usarse para determinar la pureza de cloruro de sodio u otros analitos en aguas.


![Los valores de Kps de los precipitados son:
Kps AgCl =1,8 x 10-10
Kps Ag2CrO4 = 1,1 x 10-12
Si planteamos los Kps:
Kps AgCl = [Ag+] [Cl-] = [Ag+]2 en el equilibrio
y
Kps Ag2CrO4 = [Ag+]2 [CrO42-]](https://image.slidesharecdn.com/mtododemohr-131214121230-phpapp02/75/Metodo-de-mohr-4-2048.jpg)
![Con lo cual:
Kps Ag2CrO4 = Kps AgCl [CrO42-]
Despejando:
[CrO42-] = Kps Ag2CrO4 / Kps AgCl
Esto da un resultado de 6,1 x 10-3, lo cual implica que el cromato es claramente
mas insoluble que el cloruro de plata.
Se trabaja con concentraciones que oscilan entre 2,5 x 10-3 y 5 x 10-4, pues con
esto basta para ver el color.
Con concentraciónes mas altas interfiere el color amarillento del cromato en la
solución antes del punto de equivalencia.](https://image.slidesharecdn.com/mtododemohr-131214121230-phpapp02/75/Metodo-de-mohr-5-2048.jpg)










![Limitaciones:
Debe
trabajarse en medio ácido. De lo contrario el hierro hidroliza para formar
hidróxido ferrico.
Fe3+ + H2O <==> Fe(OH)3 + 3 H+
Un
problema que se presenta aquí, es que tenemos dos precipitados, y por lo tanto
competiran entre sí.
Para el cloruro:
Ag+ + Cl- <==> AgCl (s)
Kps = [Cl-] [Ag+] = 1,8 x 10-10
Para el sulfocianuro:
Ag+ + SCN- <==> AgSCN (s) Kps = [SCN-] [Ag+] = 1,1 x 10-12](https://image.slidesharecdn.com/mtododemohr-131214121230-phpapp02/75/Metodo-de-mohr-16-2048.jpg)
![¿Hasta dónde se produce este efecto de desplazamiento?
AgX (s) + SCN- AgSCN (s) + X-
Si planteamos la constante de equilibrio y multiplicando y dividiendo por la
concentración de ion plata, resulta:
Keq = ([X-] / [SCN-]) . ([Ag+] / [Ag+]) = Kps AgX / Kps AgSCN
~ 160.
Lo que evidencia que es mucho mas insoluble el sulfocianuro y que
efectivamente disolverá precipitado AgX causando error en la determinación.](https://image.slidesharecdn.com/mtododemohr-131214121230-phpapp02/75/Metodo-de-mohr-17-2048.jpg)
