Este documento presenta el temario de la asignatura Bioquímica de la Nutrición I de la Licenciatura en Nutrición de la Universidad Nacional de Formosa. El temario incluye ocho temas principales: elementos biógenos y agua, regulación del pH en los organismos vivos, minerales, hidratos de carbono, lípidos, proteínas, enzimas y ácidos nucleicos. Cada tema contiene diferentes subtemas que se abordarán como parte de la asignatura.



















![TEMA 1: ELEMENTOS BIÓGENOS Y AGUA
Extracto de Composición química del organismo en Blanco, A. (2007). Química Bioló-
gica (8va. ed.). Buenos Aires: El Ateneo.
Elementos biógenos
La vida apareció en la Tierra muchos millones de años después de la formación del planeta. Los
elementos básicos de la materia viviente fueron seleccionados entre aquellos existentes en la
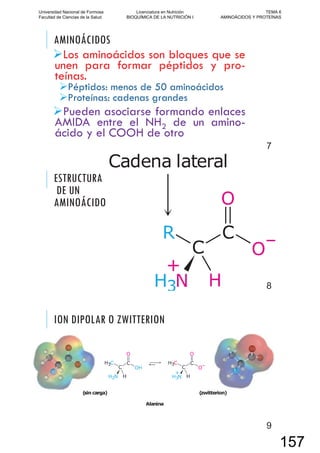
corteza y atmósfera terrestres.
No todos los elementos que forman parte de la materia inanimada se utilizaron para la estructu-
ración de los seres vivos. Sólo una pequeña proporción de ellos, a los cuales se los denomina
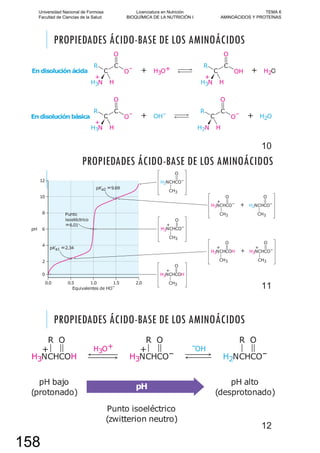
elementos biógenos, participan en la composición de organismos vivientes. En mamíferos, ani-
males de gran complejidad, se ha demostrado la presencia de apenas veinte elementos, cuatro
de los cuales (oxígeno, carbono, hidrógeno y nitrógeno) representan alrededor del 96% del peso
corporal total.
Con un criterio cuantitativo, los elementos biógenos pueden clasificarse en tres categorías:
A) Primarios. Son el oxígeno, el carbono, el hidrógeno y el nitrógeno. A este grupo suelen
agregarse también el calcio y el fósforo. En conjunto, estos seis elementos representan
más del 98% del peso corporal total.
El oxígeno y el hidrógeno forman la molécula de agua, la sustancia más abundante del
organismo. Los elementos carbono, oxígeno, hidrógeno, nitrógeno y fósforo participan
en la constitución de las moléculas orgánicas fundamentales de la materia viva. El calcio
se halla principalmente en tejido óseo y, al estado iónico, interviene en muchos procesos
fisiológicos.
B) Secundarios. El potasio, el azufre, el sodio, el cloro, el magnesio y el hierro pertenecen
a esta categoría. Se encuentran en cantidades porcentualmente mucho menores que las
indicadas para los anteriores. Forman sales y iones inorgánicos, e integran moléculas
orgánicas.
El Na+ y el Cl- son los principales iones extracelulares y el K+ es el principal ion intrace-
lular. El Mg2+ es indispensable en numerosas reacciones catalizadas por enzimas. El Fe
es componente esencial de sustancias muy importantes, entre ellas la hemoglobina. El
S [azufre] forma parte de casi todas las proteínas y de otras moléculas de interés bioló-
gico.
C) Oligoelementos. También denominados microconstituyentes. elementos oligodinámi-
cos o vestigiales, están presentes en los tejidos en cantidades extremadamente peque-
ñas en relación con la masa total.
El yodo es constituyente de la hormona tiroidea. Los otros (Cu, Mn, Co, Zn y Mo), aun
en cantidades ínfimas, son indispensables para el desarrollo normal de las funciones
vitales. Casi todos son factores necesarios para la actividad de catalizadores biológicos
(enzimas).
Universidad Nacional de Formosa
Facultad de Ciencias de la Salud
Licenciatura en Nutrición
BIOQUÍMICA DE LA NUTRICIÓN I
TEMA 1
ELEMENTOS BIÓGENOS Y AGUA
21](https://image.slidesharecdn.com/00-apunteasignatura-190413114359/85/Bioquimica-2-21-320.jpg)


![Ácidos y
Bases
Parte 1: Fundamentos
1
1. Equilibrio
Químico
2
1. Equilibrio Químico
Dada la reacción:
aA + bB cC + dD
En el equilibrio, su constante (K)
será:
K=
[C]c.[D]d
[A]a.[B]b
3
Universidad Nacional de Formosa
Facultad de Ciencias de la Salud
Licenciatura en Nutrición
BIOQUÍMICA DE LA NUTRICIÓN I
TEMA 2
ÁCIDOS Y BASES. PARTE 1
25](https://image.slidesharecdn.com/00-apunteasignatura-190413114359/85/Bioquimica-2-25-320.jpg)
![1. Equilibrio Químico
El avance de la reacción puede tomar diferentes
caminos, dependiendo del tipo de reactivos:
(Tomado de Christian, G. D. (2009). Química
Analítica (6º ed.). México: McGraw-
Hill/Interamericana.)
4
1. Equilibrio Químico
En la constante, se colocan todos los compuestos
participantes, EXCEPTO aquellos en estado sólido o
líquido.
2NaOH (ac) + H2SO4 (ac) 2SO4 (ac) + 2 H2O (l)
K =
[Na2SO4]
[NaOH]2.[H2SO4]
5
2. Autoionización
del agua
6
Universidad Nacional de Formosa
Facultad de Ciencias de la Salud
Licenciatura en Nutrición
BIOQUÍMICA DE LA NUTRICIÓN I
TEMA 2
ÁCIDOS Y BASES. PARTE 1
26](https://image.slidesharecdn.com/00-apunteasignatura-190413114359/85/Bioquimica-2-26-320.jpg)
![2. Autoionización del agua
La capacidad del agua para ionizarse, si bien es leve,
tiene importancia fundamental para la vida.
2H2O (l) H3O+
(ac) + OH-
(ac)
Esta ecuación puede representarse como:
H2O (l) H+
(ac) + OH-
(ac)
7
2. Autoionización del agua
La constante de equilibrio se denomina
Kw, tiene un valor de 1,0 x10-14:
Kw = [H+].[OH-] = 1,0 x10-14
Como en agua pura [H3O+] = [OH-] puede
escribirse: [H3O+] = [OH-] =x
x2 = 1,0 x10-14.
8
2. Autoionización del agua
Lo que implica que x es igual a la
concentración de H3O+ y la de OH-:
x2= 1 x10 14= 1 x10 7
[H3O+] = 1x10-7 M
[OH-] = 1x10-7 M
9
Universidad Nacional de Formosa
Facultad de Ciencias de la Salud
Licenciatura en Nutrición
BIOQUÍMICA DE LA NUTRICIÓN I
TEMA 2
ÁCIDOS Y BASES. PARTE 1
27](https://image.slidesharecdn.com/00-apunteasignatura-190413114359/85/Bioquimica-2-27-320.jpg)
![2. Autoionización del agua
Si se establece una medida denominada pX, que se
defina como pX = -log X, donde X puede ser
concentración o constante de equilibrio, podrá
establecerse:
pKw = - log Kw = 14
pH = - log [H3O+] = 7
pOH = - log [OH-] = 7
10
2. Autoionización del agua
Si se utiliza el pH para establecer una escala, la
misma podrá tener valores de 0 a 14:
• 7 será el valor de la neutralidad.
• Valores entre 0 y 7 corresponderán a soluciones
ÁCIDAS.
• Valores entre 7 y 14 corresponderán a soluciones
ALCALINAS.
11
2. Autoionización
del agua
Relación entre
[H+] y [OH-]
con el pH
12
Universidad Nacional de Formosa
Facultad de Ciencias de la Salud
Licenciatura en Nutrición
BIOQUÍMICA DE LA NUTRICIÓN I
TEMA 2
ÁCIDOS Y BASES. PARTE 1
28](https://image.slidesharecdn.com/00-apunteasignatura-190413114359/85/Bioquimica-2-28-320.jpg)







![4. Fuerza de ácidos y bases
Comparación entre el pH en ácidos
fuertes y el pH en ácidos débiles
Ejemplo:
• HCl 1 x10-3 M pH = 3,00
• H2CO3 1 x10-3 M pH = 4,68
34
4. Fuerza de ácidos y bases
Comparación entre el pH en ácidos
fuertes y el pH en ácidos débiles
Ejemplo:
• HCl pH = 3,00 [H+] = 1 x10-3 M
H2CO3 pH = 4,68 [H+] = 2,1 x10-5 M
35
4. Fuerza de ácidos y bases
Comparación entre el pH en ácidos fuertes
y el pH en ácidos débiles
1 M
2,1 M
= 47,6
La concentración de H+ en el HCl 1 x10-3 M es
47,6 veces mayor que la concentración de H+ en
la solución de H2CO3 de la misma concentración.
36
Universidad Nacional de Formosa
Facultad de Ciencias de la Salud
Licenciatura en Nutrición
BIOQUÍMICA DE LA NUTRICIÓN I
TEMA 2
ÁCIDOS Y BASES. PARTE 1
36](https://image.slidesharecdn.com/00-apunteasignatura-190413114359/85/Bioquimica-2-36-320.jpg)




![TEMA 2: ÁCIDOS Y BASES – PARTE 1
Responda o resuelva las siguientes actividades:
1. Explique el significado de pH, pOH y pKw, empleando los conceptos de equilibrio
químico y autoionización del agua.
2. Dé las definiciones de ácidos y bases según Arrhenius.
3. Dé las definiciones de Ácidos y Bases de Brønsted-Lowry.
4. Complete la siguiente tabla:
Com-
puesto
Peso Mo-
lecular
(g/mol)
Tipo de
compuesto
(a)
Masa en
1 L de
solución
(g) (b)
Molari-
dad
(M,
mol/L) (c)
Ka o Kb
(d) [H+
]
(M, mol/L)
pH
HNO3 0,063
KOH 0,048
H2CO3 2,52 3,87
NH3 0,153 2,51x10-11
(a) Ácido fuerte, base fuerte, ácido débil o base débil
(b) La masa empleada en cada caso es un ejemplo particular dado para este ejercicio.
(c) El cálculo de la molaridad debe realizarse considerando la masa de compuesto (co-
lumna anterior) en un litro de solución.
(d) Ka si es la constante de disociación de un ácido, o Kb si es la constante de disociación
de una base. Deberá buscar este dato en libros o internet. Recuerde que los ácidos
y bases fuertes se disocian completamente, no siendo necesaria la búsqueda de su
Ka o Kb.
5. Escriba las ecuaciones de disociación de los compuestos listados en el punto
anterior. Para cada ecuación de disociación, realice un gráfico de concentracio-
nes de compuestos en función del tiempo (Tomar ejemplo de las diapositivas 4
y 33 del material teórico).
6. Realice y balancee las ecuaciones de neutralización de las siguientes reaccio-
nes:
a. H2SO4 + KOH
b. HNO3 + Ca(OH)2
c. HCl + Fe(OH)3
Universidad Nacional de Formosa
Facultad de Ciencias de la Salud
Licenciatura en Nutrición
BIOQUÍMICA DE LA NUTRICIÓN I
TEMA 2
ÁCIDOS Y BASES - PARTE 1
41](https://image.slidesharecdn.com/00-apunteasignatura-190413114359/85/Bioquimica-2-41-320.jpg)






![2. Efecto de ion común
El efecto del ion común es el desplazamiento
del equilibrio causado por la adición de un
compuesto que tiene un ion común con la
sustancia disuelta.
Este efecto tiene una función importante en la
determinación del pH en una solución.
Chang, R. (2010). Química (10º ed.). México: McGraw-Hill / Interamericana.
19
2. Efecto de ion común
¿Cómo puede calcularse el valor del pH
que tendrá una solución con un ácido
débil y su sal?
Para entender cuál es el efecto del ion común en el pH de la
solución, debe hacerse foco en la ecuación de disociación de un
ácido débil (o base débil):
HA(ac) H+
(ac) + A-
(ac)
20
2. Efecto de ion común
La constante de ionización de esa reacción se
denomina Ka, y se calcula de la siguiente
manera:
Ka=
[H+].[A ]
[HA]
21
Universidad Nacional de Formosa
Facultad de Ciencias de la Salud
Licenciatura en Nutrición
BIOQUÍMICA DE LA NUTRICIÓN I
TEMA 2
ÁCIDOS Y BASES. PARTE 2
49](https://image.slidesharecdn.com/00-apunteasignatura-190413114359/85/Bioquimica-2-49-320.jpg)
![2. Efecto de ion común
Como el pH está determinado por la
concentración de iones hidrógeno o protones
([H+] puede despejarse la ecuación de la
siguiente forma:
[H+] =
Ka.[HA]
[A ]
22
2. Efecto de ion común
• La Ka es constante, y es una característica
propia de cada ácido débil.
• Si se comparan dos o más ácidos débiles, el
que tenga el valor de Ka mayor será más
fuerte que los otros con valores menores.
• La constante de disociación de una base débil
se denomina Kb.
23
2. Efecto de ion común
De la ecuación [H+] =
Ka.[HA]
[A ]
puede obtenerse lo siguiente:
• El aumento de la concentración del ácido débil aumenta la
concentración de H+.
• El aumento de la concentración de anión, por ejemplo por
adición de una sal que contenga el anión del ácido débil
como ion común, disminuirá la concentración de H+.
• Si la concentración del anión (A-) y la concentración de ácido
(HA) son iguales, entonces la concentración de H+ será igual
a Ka.
24
Universidad Nacional de Formosa
Facultad de Ciencias de la Salud
Licenciatura en Nutrición
BIOQUÍMICA DE LA NUTRICIÓN I
TEMA 2
ÁCIDOS Y BASES. PARTE 2
50](https://image.slidesharecdn.com/00-apunteasignatura-190413114359/85/Bioquimica-2-50-320.jpg)
![2. Efecto de ion común
En ocasiones es más sencillo trabajar con el valor de pH en vez
del valor de concentración de iones.
Para ello, existe una variante de la ecuación [H+] =
Ka.[HA]
[A ]
, la
cual se escribe de la siguiente manera:
pH =pKa log
[HA]
[A ]
Esta es la ecuación de Henderson – Hasselbalch.
25
3. Soluciones
amortiguadoras
26
3. Soluciones amortiguadoras
Una disolución amortiguadora, regulador o
tampón es una disolución de:
1) Un ácido débil o una base débil
2) Su sal
Es decir, ambos componentes deben estar
presentes.
La disolución tiene la capacidad de resistir cambios del pH
cuando se agregan pequeñas cantidades de ácido o de base.
Chang, R. (2010). Química (10º ed.). México: McGraw-Hill / Interamericana.
27
Universidad Nacional de Formosa
Facultad de Ciencias de la Salud
Licenciatura en Nutrición
BIOQUÍMICA DE LA NUTRICIÓN I
TEMA 2
ÁCIDOS Y BASES. PARTE 2
51](https://image.slidesharecdn.com/00-apunteasignatura-190413114359/85/Bioquimica-2-51-320.jpg)


![ACCIÓN AMORTIGUADORA
1) Agregado de ácido: Actúa el
HCO3
-
H+
(ac) + HCO3
-
(ac) H2CO3(ac)
4. Acción fisiológica del sistema
amortiguador CO2 / H2CO3
-
34
ACCIÓN AMORTIGUADORA
2) Agregado de base: Actúa el
H2CO3
H2CO3(ac) + OH-
(ac)
HCO3
-
(ac) + H2O(l)
4. Acción fisiológica del sistema
amortiguador CO2 / H2CO3
-
35
Horton, H. R., Moran, L. A., Scrimgeour, K. G., Perry, M.
D., & Rawn, J. D. (2008). Principios de Bioquímica
(4º ed.). México: Pearson Educación.
Regulación del pH en la
sangre de los mamíferos. El
pH de la sangre está
controlado por la relación de
[HCO3
-] entre PCO2, en los
espacios aéreos de los
pulmones. Cuando el pH de la
sangre disminuye por exceso
de H+, PCO2 aumenta en los
pulmones y restaura el
equilibrio. Cuando aumenta la
concentración de HCO3
- porque
aumenta el pH de la sangre, el
CO2 (gaseoso) se disuelve en la
sangre y se restaura de nuevo
el equilibrio.
4. Acción fisiológica del sistema
amortiguador CO2 / H2CO3
-
36
Universidad Nacional de Formosa
Facultad de Ciencias de la Salud
Licenciatura en Nutrición
BIOQUÍMICA DE LA NUTRICIÓN I
TEMA 2
ÁCIDOS Y BASES. PARTE 2
54](https://image.slidesharecdn.com/00-apunteasignatura-190413114359/85/Bioquimica-2-54-320.jpg)
![5. Situaciones
patológicas
asociadas a la
regulación del pH
37
El valor normal del pH en la sangre
humana es de aproximadamente 7,4
[con frecuencia se establece el rango
entre 7,36 y 7,42]. Esto se denomina
con pH fisiológico.
5. Situaciones patológicas asociadas a
la regulación del pH
Horton, H. R., Moran, L. A., Scrimgeour, K. G., Perry, M. D., & Rawn, J. D. (2008).
Principios de Bioquímica (4º ed.). México: Pearson Educación.
38
La sangre de pacientes que padecen ciertas
enfermedades, como diabetes, pueden tener
valores menores de pH, condición que se llama
acidosis.
5. Situaciones patológicas asociadas a
la regulación del pH
Horton, H. R., Moran, L. A., Scrimgeour, K. G., Perry, M. D., & Rawn, J. D. (2008).
Principios de Bioquímica (4º ed.). México: Pearson Educación.
39
Universidad Nacional de Formosa
Facultad de Ciencias de la Salud
Licenciatura en Nutrición
BIOQUÍMICA DE LA NUTRICIÓN I
TEMA 2
ÁCIDOS Y BASES. PARTE 2
55](https://image.slidesharecdn.com/00-apunteasignatura-190413114359/85/Bioquimica-2-55-320.jpg)
![El estado en el que de la sangre es mayor a 7,4
[o el valor máximo de referencia] se llama
alcalosis y puede deberse a vómitos
persistentes y prolongados (pérdida de ácido
clorhídrico del estómago) o hiperventilación
(excesiva pérdida de ácido carbónico en forma de
dióxido de carbono).
5. Situaciones patológicas asociadas a
la regulación del pH
Horton, H. R., Moran, L. A., Scrimgeour, K. G., Perry, M. D., & Rawn, J. D. (2008).
Principios de Bioquímica (4º ed.). México: Pearson Educación.
40
Universidad Nacional de Formosa
Facultad de Ciencias de la Salud
Licenciatura en Nutrición
BIOQUÍMICA DE LA NUTRICIÓN I
TEMA 2
ÁCIDOS Y BASES. PARTE 2
56](https://image.slidesharecdn.com/00-apunteasignatura-190413114359/85/Bioquimica-2-56-320.jpg)



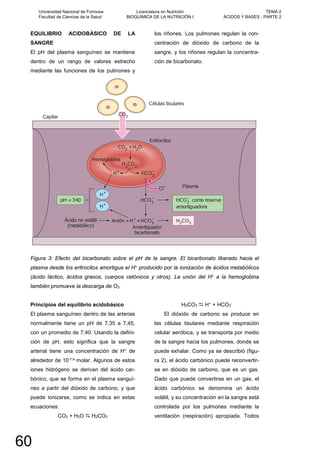
![los otros ácidos en la sangre —entre ellos
el ácido láctico, los ácidos grasos, los cuer-
pos cetónicos, etc.— son ácidos no voláti-
les.
En circunstancias normales, el H+ libe-
rado por ácidos metabólicos no volátiles no
afecta el pH de la sangre porque estos
iones hidrógeno están unidos a moléculas
que funcionan como amortiguadores. El
principal amortiguador en el plasma es el
ion bicarbonato (HCO3
-), y amortigua H+
como se muestra en la figura 3 y se descri-
be en esta ecuación:
H+ + HCO3
- H2CO3
Esta reacción amortiguadora no podría
continuar para siempre porque el HCO3
-
libre finalmente desaparecería. Si ocurriera
esto, la concentración de H+ aumentaría, y
el pH de la sangre disminuiría. Aun así, en
circunstancias normales, el H+ excesivo se
elimina en la orina mediante los riñones.
Por medio de esta acción, y mediante su
capacidad para producir bicarbonato, los
riñones se encargan de mantener una con-
centración normal de bicarbonato libre en el
plasma.
Una disminución del pH sanguíneo por
debajo de 7,35 se llama acidosis porque el
pH está hacia el lado ácido de lo normal. La
acidosis no significa ácido (pH de menos
de 7); por ejemplo, un pH sanguíneo de 7,2
representa acidosis grave. De modo simi-
lar, un aumento del pH de la sangre por
arriba de 7,45 se llama alcalosis. Estos dos
estados se clasifican en componentes res-
piratorio y metabólico del equilibrio acido-
básico (cuadro 1).
La acidosis respiratoria se origina por venti-
lación insuficiente (hipoventilación), que da
por resultado un aumento de la concentra-
ción plasmática de dióxido de carbono y,
así, de ácido carbónico. En contraste, la
alcalosis respiratoria se produce por venti-
lación excesiva (hiperventilación). La aci-
dosis metabólica puede sobrevenir por
producción excesiva de ácidos no volátiles;
por ejemplo, puede ser el resultado de pro-
ducción excesiva de cuerpos cetónicos en
la diabetes mellitus no controlada. También
puede aparecer por la pérdida de bicarbo-
nato, en cuyo caso no habría suficiente
bicarbonato libre para amortiguar los ácidos
no volátiles (esto ocurre en la diarrea debi-
do a la pérdida de bicarbonato derivado del
jugo pancreático). En contraste, la alcalosis
metabólica puede depender de demasiado
bicarbonato (quizá por administración por
vía intravenosa) o de ácidos no volátiles
insuficientes (tal vez como resultado de
vómitos excesivos). Los vómitos excesivos
pueden causar alcalosis metabólica por
pérdida del ácido en el jugo gástrico, que
normalmente se absorbe desde el intestino
hacia la sangre.
Puesto que el componente respiratorio
del equilibrio acidobásico está representa-
do por la concentración plasmática de dió-
xido de carbono, y el componente
metabólico está representado por la con-
centración de bicarbonato libre, el estudio
del equilibrio acidobásico puede simplificar-
se. Un pH normal en sangre arterial se
obtiene cuando hay una proporción apro-
piada entre bicarbonato y dióxido de car-
bono. Es posible calcular el pH dados estos
valores, y un pH normal se obtiene cuando
la proporción de estas concentraciones es
de 20 a 1. Esto es proporcionado por la
ecuación de Henderson-Hasselbalch:
pH = 6,1 + log
[HCO3
-
]
0,03PCO2
Universidad Nacional de Formosa
Facultad de Ciencias de la Salud
Licenciatura en Nutrición
BIOQUÍMICA DE LA NUTRICIÓN I
TEMA 2
ÁCIDOS Y BASES - PARTE 2
61](https://image.slidesharecdn.com/00-apunteasignatura-190413114359/85/Bioquimica-2-61-320.jpg)

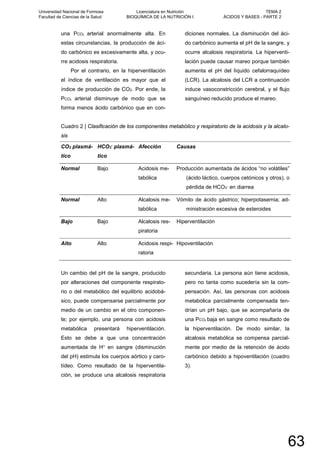
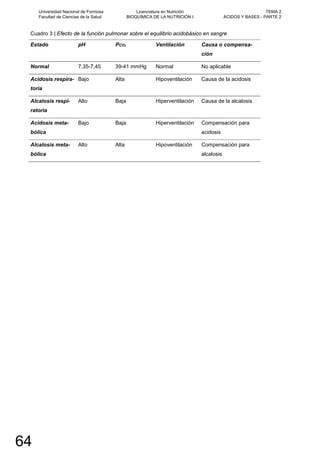






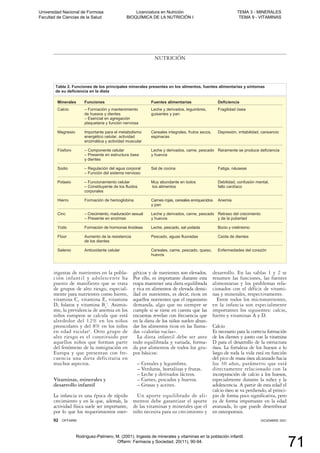
























































































![NICOTINAMIDA ADENINA DINUCLEÓTIDO (FOSFATO)
OXIDADA Y REDUCIDA
[NAD(P)+ / NAD(P)H]
34
FLAVINA
MONO
NUCLEÓTIDO
[FMN]
FLAVINA
ADENINA
DINUCLEÓTIDO
[FAD]
35
REGULACIÓN DE LA
ACTIVIDAD ENZIMÁTICA
36
Universidad Nacional de Formosa
Facultad de Ciencias de la Salud
Licenciatura en Nutrición
BIOQUÍMICA DE LA NUTRICIÓN I
TEMA 7
ENZIMAS
186](https://image.slidesharecdn.com/00-apunteasignatura-190413114359/85/Bioquimica-2-186-320.jpg)
















![CAPÍTULO 44 Micronutrientes: vitaminas y minerales 473
FIGURA 44-8 Función de la vitamina K en la síntesis de
γ-carboxiglutamato.
O2
Vitamina K hidroquinona
Vitamina K quinona
reductasa
Vitamina K epóxido
reductasa
Sulfhidrilo
Sulfhidrilo
Disulfuro
Disulfuro
NADP
NADPH
Quinona
reductasa
Vitamina K
epoxidasa
Vitamina K epóxido
Carbanión glutamato
CH3
R
OH
OH
CH3
R
Vitamina K quinona
O
O
CH3
R
O
O
O
HN CH C
CH2
CO2
O
COOCH
Residuo glutamato
HN CH C
CH2
O
COOCH2
Residuo carboxiglutamato
HN
CH
CH C
CH2
O
COOOOC
+
No
enzimática
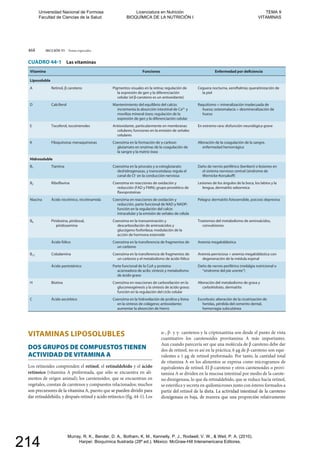
La vitamina K es la coenzima
para la carboxilación de glutamato
en la modificación postsintética
de proteínas de unión a calcio
La vitamina K es el cofactor para la carboxilación de residuos gluta-
mato en la modificación postsintética de proteínas para formar el
aminoácido poco común γ-carboxiglutamato (Gla) (fig. 44-8). Ini-
cialmente, la vitamina K hidroquinona se oxida hacia el epóxido,
que activa un residuo glutamato en el sustrato proteínico hacia
un carbanión, que reacciona de modo no enzimático con dióxido de
carbono para formar γ-carboxiglutamato. La vitamina K epóxido se
reduce hacia la quinona por medio de una reductasa sensible a war-
farina, y la quinona se reduce hacia la hidroquinona activa median-
te la misma reductasa sensible a warfarina o una quinona reductasa
insensible a warfarina. En presencia de warfarina es imposible redu-
cir la vitamina K epóxido, pero se acumula y se excreta. Si se propor-
ciona suficiente vitamina K (como la quinona) en la dieta, puede
reducirse hacia la hidroquinona activa por medio de la enzima in-
sensible a warfarina, y la carboxilación puede continuar, con utiliza-
ción estoiquiométrica de vitamina K y excreción del epóxido. Una
dosis alta de vitamina K es el antídoto para una sobredosis de war-
farina.
La protrombina y varias otras proteínas del sistema de coagula-
ción de la sangre (factores VIII, IX y X, y proteínas C y S, cap. 50)
contienen, cada una, de 4 a 6 residuos γ-carboxiglutamato. El
γ-carboxiglutamato produce quelación de iones de calcio y, de esta
manera, permite la unión de las proteínas de la coagulación de la san-
gre a membranas. En la deficiencia de vitamina K, o en presencia de
warfarina, se libera hacia la circulación un precursor anormal de la
protrombina (preprotrombina) que contiene poco γ-carboxigluta-
mato o no lo contiene, y que es incapaz de quelar calcio.
La vitamina K también es importante en la
síntesis de proteínas de unión a calcio óseo
El tratamiento de mujeres embarazadas con warfarina puede llevar a
anormalidades óseas fetales (síndrome fetal por warfarina). Dos pro-
teínas que contienen γ-carboxiglutamato se encuentran en el hueso:
la osteocalcina y la proteína Gla de matriz ósea. La osteocalcina tam-
bién contiene hidroxiprolina, de modo que su síntesis depende de
las vitaminas tanto K como C; más aún, su síntesis es inducida por la
vitamina D. La liberación de osteocalcina hacia la circulación pro-
porciona un índice del estado en cuanto a vitamina D.
VITAMINAS HIDROSOLUBLES
LA VITAMINA B1 (TIAMINA) TIENE
UNA FUNCIÓN CLAVE EN EL
METABOLISMO DE CARBOHIDRATOS
La tiamina tiene una función esencial en el metabolismo que gene-
ra energía, especialmente en el metabolismo de carbohidratos (fig.
44-9). El difosfato de tiamina es la coenzima para tres complejos de
múltiples enzimas que catalizan reacciones de descarboxilación oxi-
dativa: piruvato deshidrogenasa en el metabolismo de carbohidra-
tos (cap. 17); α-cetoglutarato deshidrogenasa en el ciclo del ácido
cítrico (cap. 17), y la cetoácido de cadena ramificada deshidrogena-
sa que participa en el metabolismo de la leucina, isoleucina y valina
(cap. 29). En cada caso, el difosfato de tiamina proporciona un car-
bono reactivo en la parte triazol que forma un carbanión, que luego
se agrega al grupo carbonilo, p. ej., piruvato. El compuesto añadido
a continuación se descarboxila, con lo que se elimina CO2. El difos-
fato de tiamina también es la coenzima para la transcetolasa, en la
vía de la pentosa fosfato (cap. 21).
El trifosfato de tiamina participa en la conducción nerviosa;
fosforila y, de esta manera, activa, un canal de cloruro en la mem-
brana del nervio.
La deficiencia de tiamina afecta el sistema
nervioso y el corazón
La deficiencia de tiamina puede dar por resultado tres síndromes:
una neuritis periférica crónica, el beriberi, que puede o no mostrar
vínculo con insuficiencia cardiaca y edema; beriberi pernicioso
agudo (fulminante) (beriberi cardiovascular agudo [shoshin-beri-
beri]), en el cual predominan la insuficiencia cardiaca y anormali-
dades metabólicas, sin neuritis periférica, y encefalopatía de Wer-
nicke con psicosis de Korsakoff, que se relacionan en particular
con el abuso del consumo de alcohol y narcóticos. La función del
difosfato de tiamina en la piruvato deshidrogenasa significa que
cuando hay deficiencia se observa conversión alterada de piruvato
en acetil CoA. En sujetos que consumen una dieta con contenido
relativamente alto de carbohidratos, esto origina incremento de las
FIGURA 44-8 Función de la vitamina K en la síntesis deitamina K
γ-carboxiglutamato.γ-carboxiglutamato.
en acetil CoA. En sujetos que consumen una dieta con contenidotil Co
relativamente alto de carbohidratos, esto origina incremento de lasamente alto de carbohidratos, esto origina incremento de las
Universidad Nacional de Formosa
Facultad de Ciencias de la Salud
Licenciatura en Nutrición
BIOQUÍMICA DE LA NUTRICIÓN I
TEMA 9
VITAMINAS
Murray, R. K., Bender, D. A., Botham, K. M., Kennelly, P. J., Rodwell, V. W., & Weil, P. A. (2010).
Harper. Bioquímica Ilustrada (28º ed.). México: McGraw-Hill Interamericana Editores.
219](https://image.slidesharecdn.com/00-apunteasignatura-190413114359/85/Bioquimica-2-219-320.jpg)








