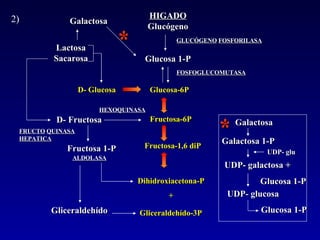
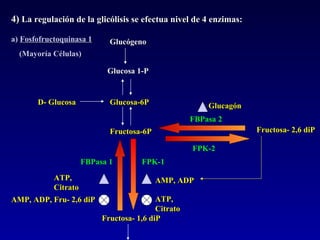
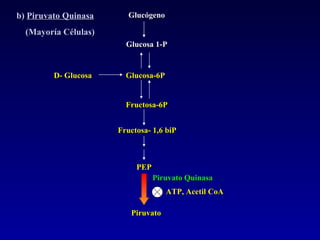
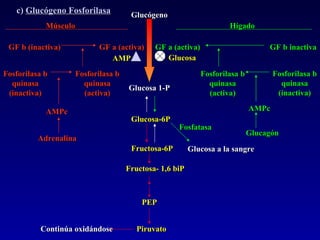
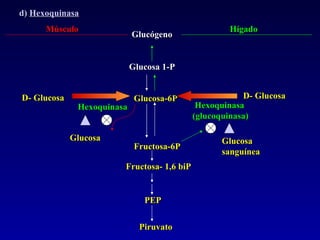
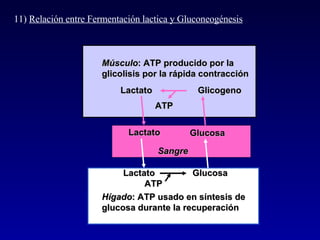
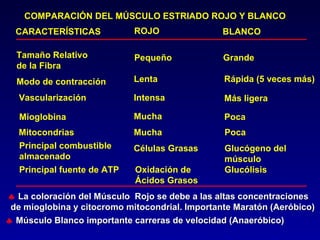
1) El documento describe las etapas de la glucólisis y la fermentación láctica, incluyendo los intermediarios y enzimas involucrados. 2) Explica que el fosfato mantiene fosforilados los intermediarios de la glucólisis para retenerlos en la célula y conservar la energía. 3) También compara las diferencias entre el músculo rojo y blanco en términos de su metabolismo y fuentes de ATP.

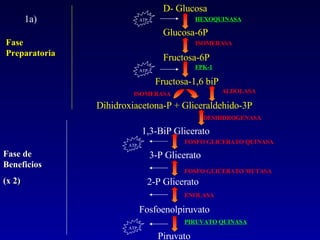



![Fosfatos de Alta Energía La necesidad de ATP en el músculo puede cambiar rápidamente. El músculo en actividad máxima usa 1.000 mmol / min kg y la concentración de ATP es 3-5 mmol / kg de músculo, es la cantidad para 10 contracciones y se agotaría en 1 seg de actividad intensa Los músculos esqueléticos y cardíacos tienen altas cantidades de fosfato de creatina (25 mmol / kg). Esta sirve para regenerar ATP, en la única reacción catalizada por la creatina quinasa Creatina-P + ADP Creatina + ATP Gº´= -12 kJ/mol En el músculo: [Creatina-P]/[ATP] = 5](https://image.slidesharecdn.com/hregu-cine2-090509112220-phpapp01/85/Clase-7-de-BQE-12-320.jpg)


![Las reacciones químicas catalizadas en las células suceden con una rápidez de 10 4 a 10 8 veces lo que es posible reproducirlas en el tubo de ensayo Reacción: Sustrato Producto k directa k inversa Tubo de ensayo: S P K equilibrio = [P]/[S] = k directa k inversa k directa k inversa El valor de K equilibrio es igual sin o con enzima](https://image.slidesharecdn.com/hregu-cine2-090509112220-phpapp01/85/Clase-7-de-BQE-16-320.jpg)
![Ecuación de Arrhenius: k: constante de velocidad R: constante de los gases ideales A: probabilidad que los choques den producto E: energía de activación Factores que afectan las enzimas E E E n e r g í a Coordenada de reacción S P [Complejo Activado] # k = A e - E/ RT](https://image.slidesharecdn.com/hregu-cine2-090509112220-phpapp01/85/Clase-7-de-BQE-17-320.jpg)
![TIPOS DE ENZIMAS: 1- Enzimas Cooperativas o Alostéricas . Dan curvas de velocidad contra sustrato que son Sigmoidales más que hiperbólicas, se denominan enzimas de control o reguladoras y por lo general están situadas en el inicio o en los puntos de ramificación de una ruta metabólica. La gráfica representa una curva sigmoidal. [S] Velocidad ( P/ t) Lc 19:26. “Yo les digo que a todo el que produce se le dará más, pero al que no tiene, se le quitará aun lo que tiene”](https://image.slidesharecdn.com/hregu-cine2-090509112220-phpapp01/85/Clase-7-de-BQE-18-320.jpg)
![K M V máx/ 2 V máx La curva representa una hipérbola rectangular. Es un comportamiento típico de una reacción de saturación [S] Velocidad ( P/ t) Michaelis-Menten establecieron los siguientes equilibrios: K asociación K disociación S + E [ES] # P + E K disociación= [E] [S]/ [ES] = Ks ES es un complejo activado con uniones no covalente y d[ES]/dt=0 (Estado estacionario). Bases mecanísticas de la ecuación de Michaelis-Menten 2- Enzimas Michaelis-Menten . Dan curvas de velocidad contra sustrato que son hiperbólicas . K catalítica](https://image.slidesharecdn.com/hregu-cine2-090509112220-phpapp01/85/Clase-7-de-BQE-19-320.jpg)
![Velocidad = K catalítica [ES] [E total ] = [E libre ] + [ES] [E libre ] = [E total ] - [ES] Ks=[E total - ES] [S / [ES Ks [ES =[E total - ES] [S Ks [ES =[E total ] [S - [ES] [S [ES Ks + [S = [E total ] [S [ES = [E total ] [S / Ks + [S Velocidad = K catalítica {[E total ] [S / Ks + [S } Por analogía: K catal [E total ] = V máxima Velocidad = V máx [S / {K M + [S }](https://image.slidesharecdn.com/hregu-cine2-090509112220-phpapp01/85/Clase-7-de-BQE-20-320.jpg)
![Metodología de Lineweaver-Burk: Se determina el recíproco de la ecuación anterior y se tiene una ecuación lineal 1/ V = K M / V máx [S + 1 / V máx Pendiente= K M / V máx 1/V máx - 1/K M 1/ [S] 1/ V Velocidad = V máx [S / {K M + [S } Ecuación de Michaelis-Menten](https://image.slidesharecdn.com/hregu-cine2-090509112220-phpapp01/85/Clase-7-de-BQE-21-320.jpg)
![Metodología de Hanes-Woolf: Se multiplica la ecuación anterior por la concentración del sustrato, S . Se tiene una ecuación lineal y el error experimental se hace menor. [S / V = K M / V máx + [S / V máx Pendiente= 1/ V máx K M / V máx - K M [S] [S] / V Con cualquiera de las dos últimas metodologías (Ec. Lineales) se tienen valores más confiables de K M y V máx, que en la forma directa (Ec. de una hipérbola).](https://image.slidesharecdn.com/hregu-cine2-090509112220-phpapp01/85/Clase-7-de-BQE-22-320.jpg)
![Inhibición Enzimática-Ecuaciones Tipos de inhibidores reversibles: Competitivo (I + E) Acompetitivo (I + ES) No-competitivo (I + E + ES) Mixto Inhibidor Competitivo: S + E [ES] # P + E + I E I K E I K E I = [E] [ I ]/ [E I ] y [Etotal] = [E]+[ES]+[E I ] [ES]= [Et] [S]/ K M ’+[S] donde K M ’= K M (1+[ I ]/ K E I ) V = V máx [S]/ K M ’+ [S]](https://image.slidesharecdn.com/hregu-cine2-090509112220-phpapp01/85/Clase-7-de-BQE-23-320.jpg)
![1/V máx - 1/K M 1/ [S] 1/ V [ I ]= 0 [ I ]= K M [ I ]= 4 K M Inhibición Competitiva: Rectas Convergentes en ORDENADA K M si [I] Inhibidor Competitivo: S + E [ES] # P + E + I E I K E I K E I = [E] [ I ]/ [E I ] y [Etotal] = [E]+[ES]+[E I ] [ES]= [Et] [S]/ K M ’+[S] donde K M ’= K M (1+[ I ]/ K E I ) V = V máx [S]/ K M ’+ [S]](https://image.slidesharecdn.com/hregu-cine2-090509112220-phpapp01/85/Clase-7-de-BQE-24-320.jpg)
![- 1/K M 1/ [S] 1/ V [ I ]= 0 [ I ]= K M [ I ]= 4 K M Inhibición Acompetitiva: Rectas Paralelas K M y V máx si [I] Inhibidor Acompetitivo: S + E [ES] # P + E + I ES I K ES I K ES I = [ES] [ I ]/ [ES I ] y [E total] = [E]+[ES]+[ES I ] V = V’ máx [S]/ K M ’’+ [S] Donde V máx’= V máx/ (1+[ I ]/ K ES I ) y K M ’’= K M (1+[ I ]/ K ES I ) [ES]= 1/V máx [E t] [S]/(1+[ I ]/ K ES I ) K M /(1+[I]/K ES I )+[S]](https://image.slidesharecdn.com/hregu-cine2-090509112220-phpapp01/85/Clase-7-de-BQE-25-320.jpg)
![- 1/K M 1/ [S] 1/ V [ I ]= 0 [ I ]= K M [ I ]= 4 K M Inhibición No-competitiva: Rectas Convergentes en ABSCISA Inhibidor No-competitivo: S + E [ES] # P + E + I ES I K ES I Si K I =K ES I = K E I y [E total] = [E]+[ES]+[E I ]+ [ES I ] V = V’ máx [S]/ K M + [S] + I E I K E I [E t] [S]/(1+[ I ]/ K I ) K M +[S] [ES]=](https://image.slidesharecdn.com/hregu-cine2-090509112220-phpapp01/85/Clase-7-de-BQE-26-320.jpg)
![Características de los Diferentes Tipos de Inhibidores Tipo de inhibición Inhibidor se combina con: Efecto aparente sobre V máx. Efecto aparente sobre K M Efecto sobre las gráficas 1/V v/s 1/ [S] E Ninguno CONVERGENTE EN el eje de la ORDENADA ES Rectas PARALELAS Competitiva Acompetitiva No-competitiva: a) Simple (K ESI =K EI ) b) Mixta 1 (K ESI K EI ) c) Mixta 2 (K ESI K EI ) E y ES Ninguno CONVERGENTE EN el eje de la ABSCISA CONVERGENTE por ENCIMA de la ABSCISA CONVERGENTE por DEBAJO de la ABSCISA](https://image.slidesharecdn.com/hregu-cine2-090509112220-phpapp01/85/Clase-7-de-BQE-27-320.jpg)
![Se investigó el efecto de un inhibidor I sobre la velocidad de una reacción catalizada enzimaticamente sobre un solo sustrato, obteniéndose los siguientes resultados: Concentración de sustrato [S] (mM) Concentración del Inhibidor [I] (mM) 0 0,5 1,0 0,33 0,20 0,14 0,50 0,33 0,25 0,67 0,50 0,40 0,80 0,67 0,57 0,83 0,71 0,63 0,05 0,10 0,20 0,40 0,80 Velocidad de reacción ( M/ min) a) Determine K M y V máxima de la enzima b) Qué tipo de inhibidor está presente](https://image.slidesharecdn.com/hregu-cine2-090509112220-phpapp01/85/Clase-7-de-BQE-28-320.jpg)
![Solución) a) Primero se determina las constantes a través del método de los recíprocos. 20 10 5 2,5 1,25 1/ [S] 3 2 1,5 1,3 1,2 1/ v [I]= 0 0,5 1,0 5 3 1 1,5 1,4 7 4 2,5 1,8 1,6](https://image.slidesharecdn.com/hregu-cine2-090509112220-phpapp01/85/Clase-7-de-BQE-29-320.jpg)
![Del gráfico se ve que V máxima no varia pero si K M con la presencia del inhibidor, luego el tipo de inhibición es competitiva 10 0 -5 -10 10 5 20 Intersección: -1/K M = -10 K M =0,1 Intersección: 1/Vmáx= 0,93 V máx=1,08 1/ v 1/ [S] [I]= 0 [I]= 0,5 [I]= 1](https://image.slidesharecdn.com/hregu-cine2-090509112220-phpapp01/85/Clase-7-de-BQE-30-320.jpg)
![Características de los Diferentes Tipos de Inhibidores Tipo de inhibición Inhibidor se combina con: Efecto aparente sobre V máx. Efecto aparente sobre K M Efecto sobre las gráficas 1/V v/s 1/ [S] E Ninguno CONVERGENTE EN el eje de la ORDENADA ES Rectas PARALELAS Competitiva Acompetitiva No-competitiva: a) Simple (K ESI =K EI ) b) Mixta 1 (K ESI K EI ) c) Mixta 2 (K ESI K EI ) E y ES Ninguno CONVERGENTE EN el eje de la ABSCISA CONVERGENTE por ENCIMA de la ABSCISA CONVERGENTE por DEBAJO de la ABSCISA](https://image.slidesharecdn.com/hregu-cine2-090509112220-phpapp01/85/Clase-7-de-BQE-31-320.jpg)
