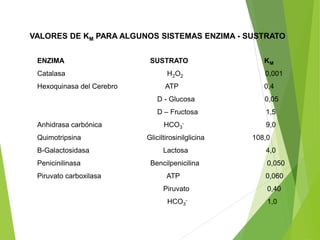
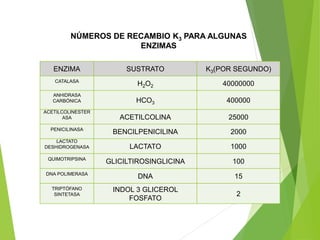
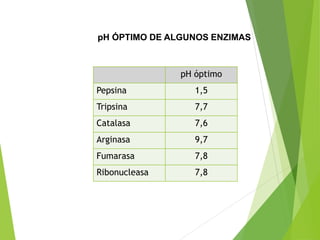
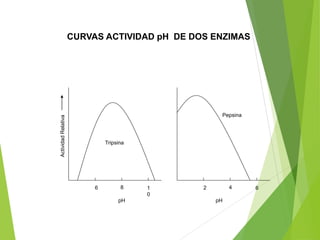
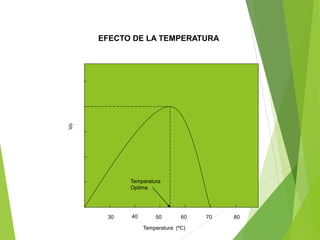
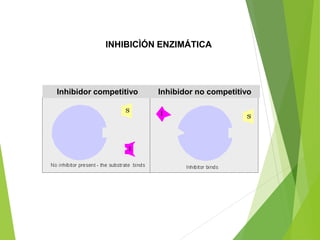
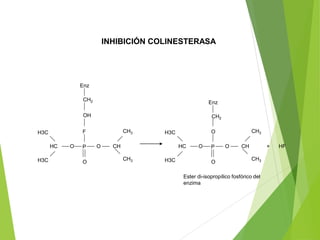
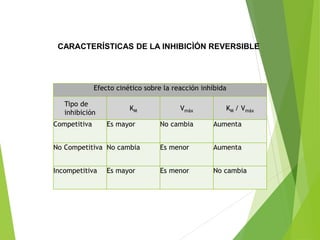
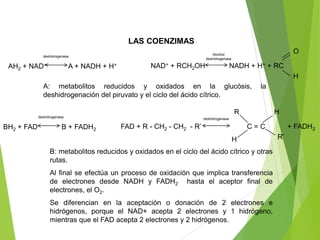
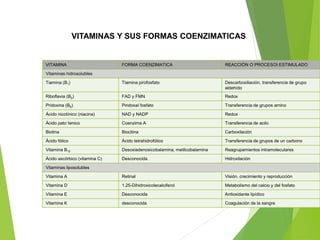
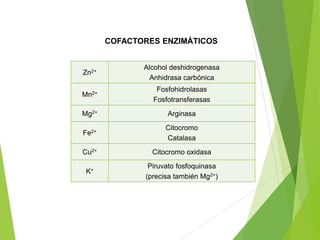
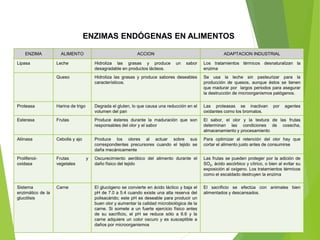
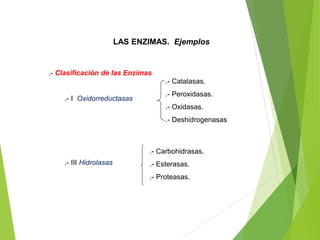
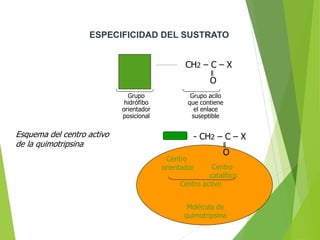
Este documento trata sobre las enzimas. Explica que las enzimas son proteínas que actúan como catalizadores de reacciones químicas en la célula. Se componen de una porción proteínica y, a veces, de un grupo prostético o coenzima. Las enzimas exhiben alta especificidad por su sustrato y tipo de reacción catalizada.









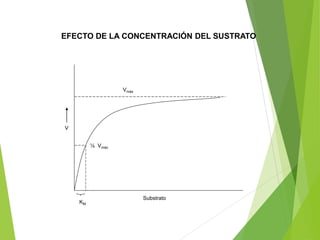
![EFECTO DE LA CONCENTRACIÓN
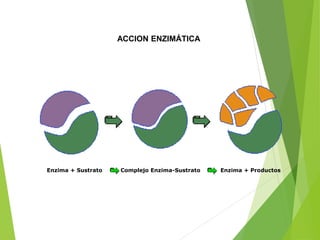
E + S ES ES E + P
Ecuación de Michaelis - Menten
VMAX [S]
KM + [S]
v =
Si KM=[S]
VMAX
2
Vo =
VMAX
[ET]
K3 =
K2 + K3
K1
KM](https://image.slidesharecdn.com/enzimas-210819170540/85/Enzimas-16-320.jpg)