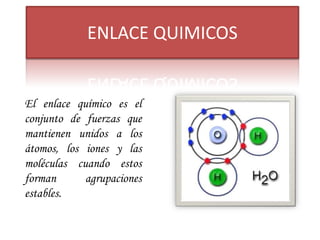
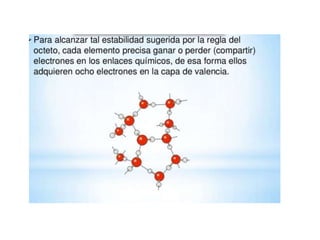
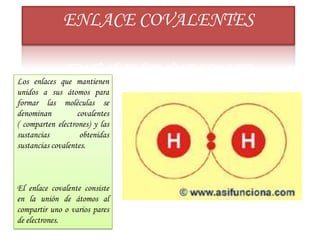
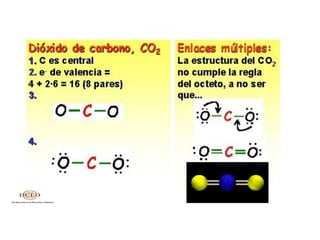
El enlace químico mantiene unidos los átomos, iones y moléculas cuando forman agrupaciones estables. La regla del octeto explica que los compuestos tienden a cumplir con 8 electrones en su capa de valencia. La electronegatividad, afinidad electrónica y energía de ionización miden la capacidad de los átomos para atraer electrones en un enlace. Los enlaces iónicos unen iones con cargas opuestas, mientras que los enlaces covalentes comparten pares de electrones entre átomos.