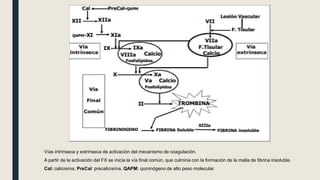
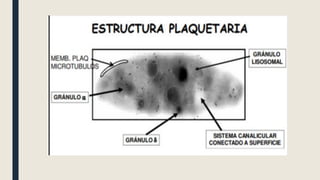
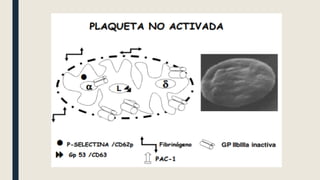
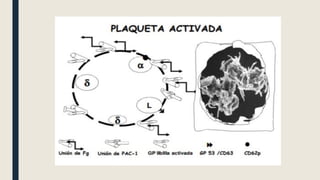
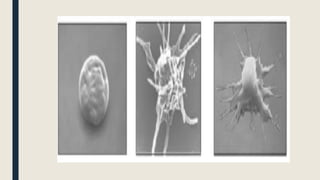
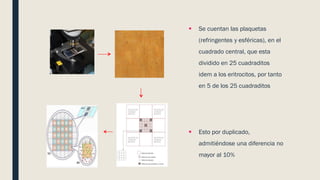
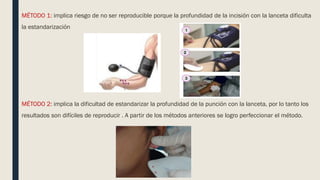
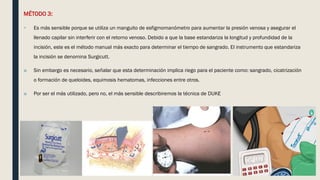
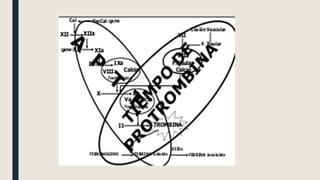
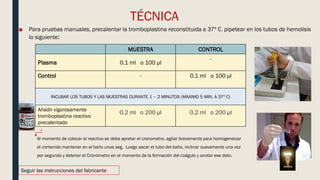
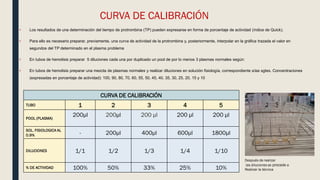
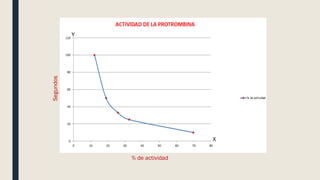
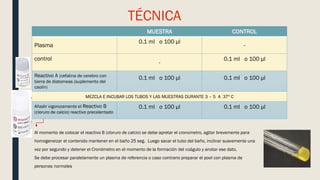
El documento describe los procesos de coagulación sanguínea, hemostasia y trombosis. Explica que la coagulación depende de tres componentes: vasos sanguíneos, plaquetas y proteínas plasmáticas. También describe las vías intrínseca y extrínseca de la coagulación y los factores de coagulación. Finalmente, ofrece detalles sobre pruebas de laboratorio relacionadas a la coagulación como el recuento de plaquetas y el tiempo de sangría.