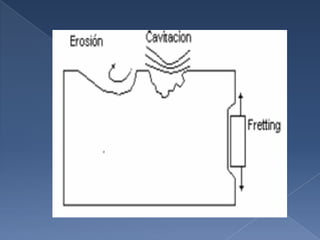
El documento describe los diferentes tipos de corrosión que puede sufrir un metal, incluyendo la corrosión química, electroquímica, atmosférica, líquida y subterránea. También explica los tipos de corrosión según la morfología del daño, como la corrosión uniforme, galvánica y por grietas. Finalmente, detalla factores que afectan la corrosión y métodos para prevenirla.