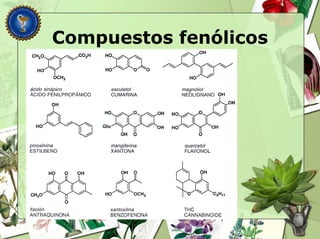
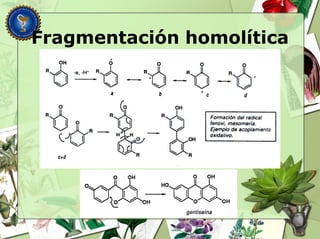
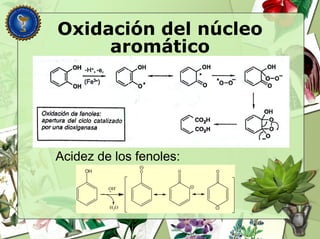
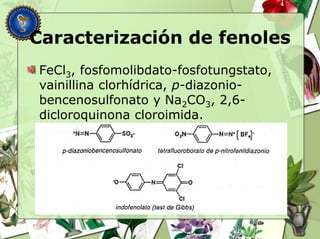
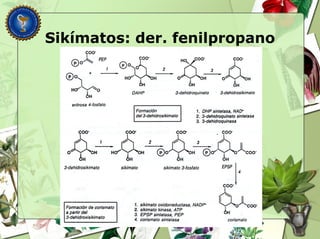
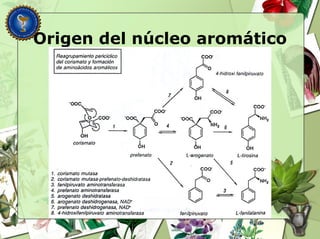
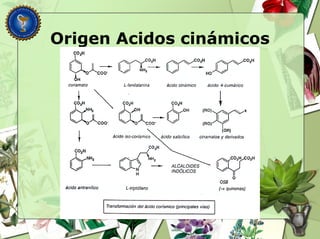
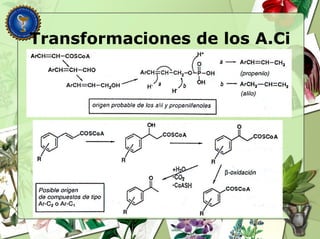
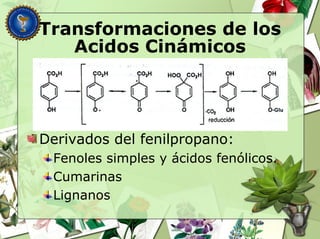
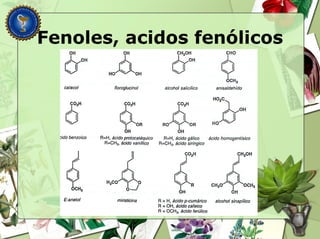
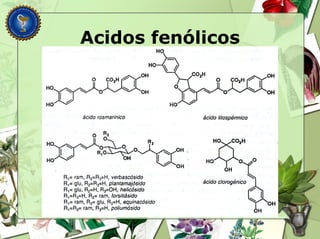
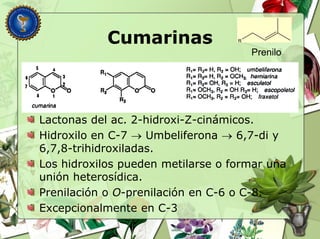
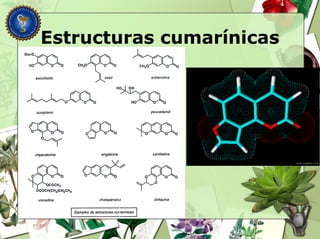
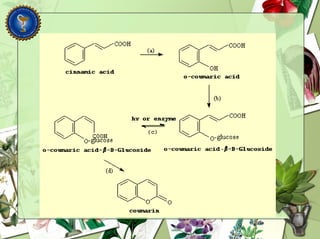
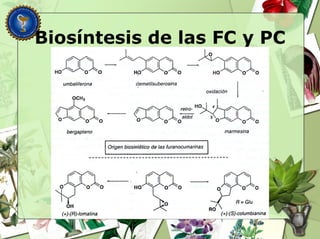
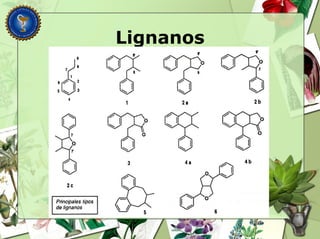
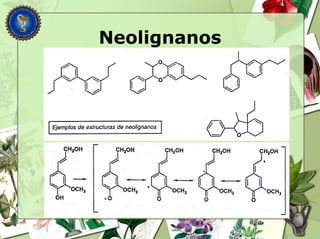
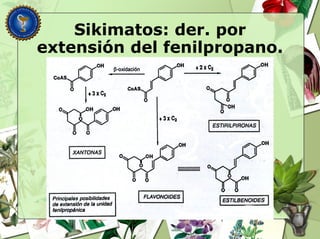
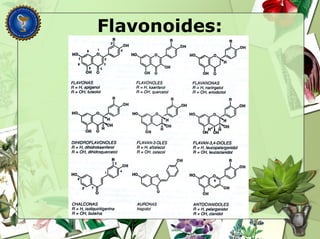
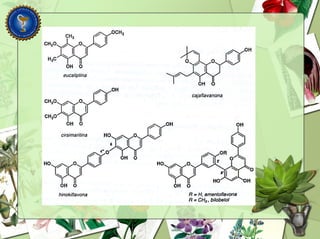
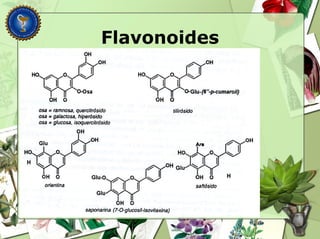
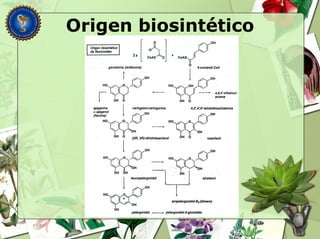
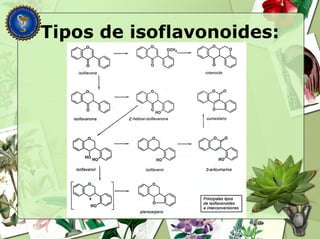
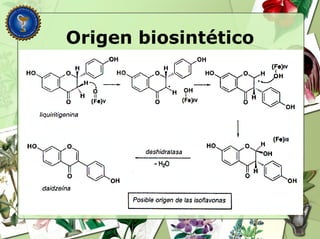
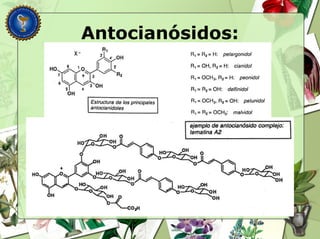
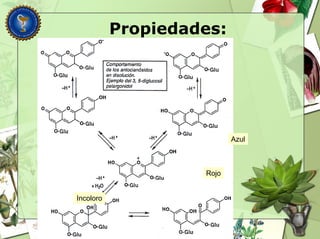
Este documento describe diferentes tipos de compuestos fenólicos encontrados en plantas, incluyendo su estructura química, origen biosintético, propiedades, extracción y caracterización. Se discuten compuestos como flavonoides, lignanos, cumarinas, isoflavonoides y antocianósidos.