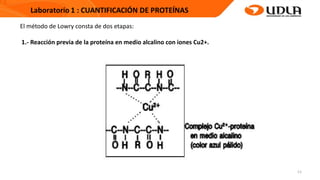
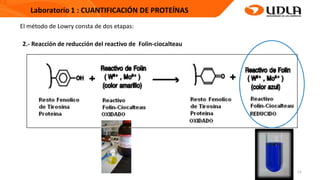
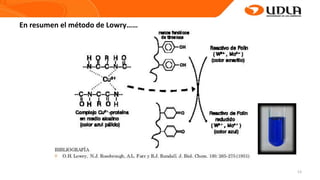
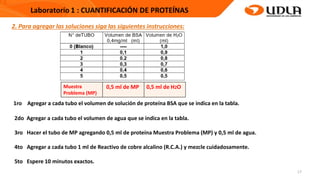
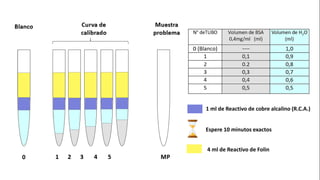
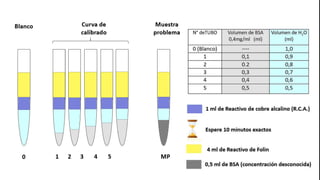
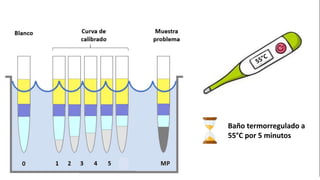
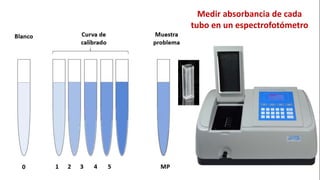
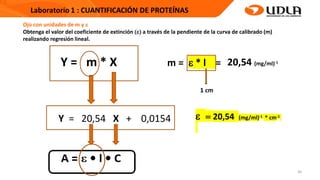
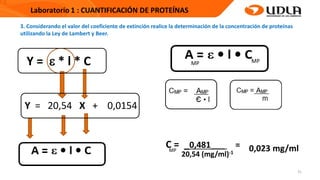
Este documento describe el procedimiento para cuantificar proteínas utilizando el método de Lowry. El método consta de dos etapas: 1) las proteínas reaccionan en un medio alcalino con iones de cobre, y 2) el reactivo de Folin reduce los productos de la reacción formando un compuesto azul cuya absorbancia depende de la concentración de proteínas. Se construye una curva de calibrado con albúmina de suero bovino para determinar la concentración de proteínas en una muestra problema.