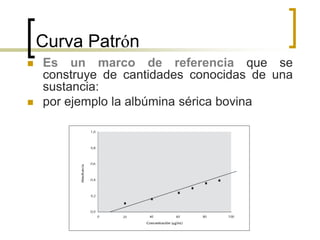
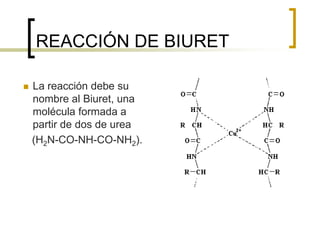
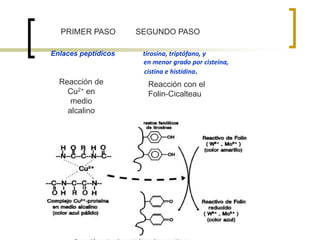
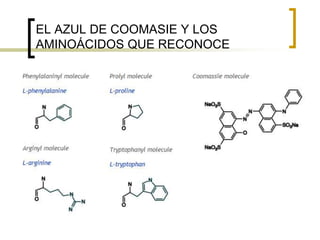
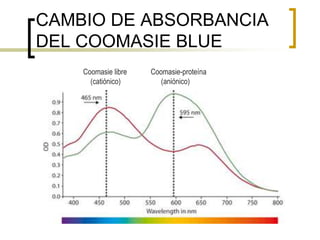
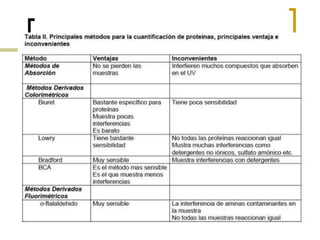
Este documento describe varios métodos para cuantificar proteínas, incluyendo espectrofotometría, la ley de Lambert-Beer, y métodos como Biuret, Lowry y Bradford. Explica cómo construir una curva estándar usando una proteína como la albúmina sérica bovina para determinar la concentración de una muestra desconocida mediante comparación con la curva. También compara la sensibilidad de los diferentes métodos de cuantificación de proteínas.