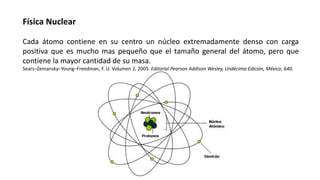
El documento trata sobre física nuclear. Explica que los átomos contienen un núcleo denso con carga positiva que es mucho más pequeño que el átomo pero contiene la mayor parte de su masa. Describe las propiedades de los núcleos atómicos y cómo se pueden modelar. Además, explica conceptos como núclidos, isotopos, fuerzas nucleares, radiactividad, decaimiento alfa, beta y gamma. Por último, introduce las nociones de actividad y vida media de los núclidos radiactivos.