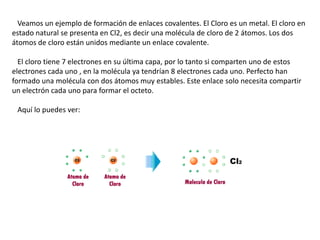
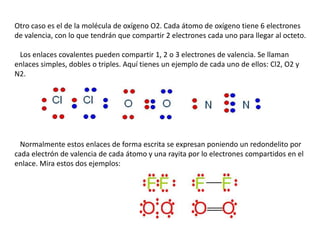
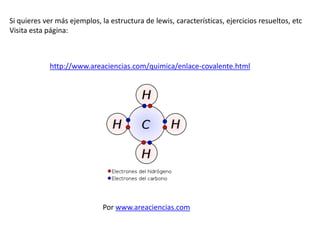
Este documento explica los enlaces covalentes, que ocurren cuando átomos no metálicos comparten electrones de valencia para completar su capa electrónica exterior con 8 electrones. Los átomos comparten 1, 2 o 3 electrones para formar enlaces simples, dobles o triples respectivamente. Por ejemplo, el cloro forma moléculas Cl2 compartiendo un electrón cada átomo, mientras que el oxígeno forma moléculas O2 compartiendo 2 electrones cada átomo.