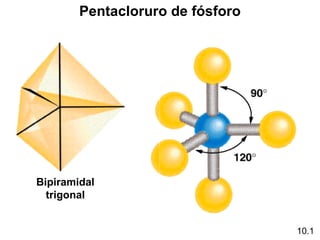
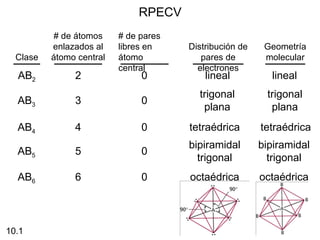
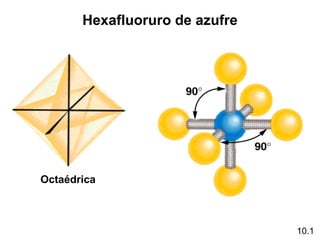
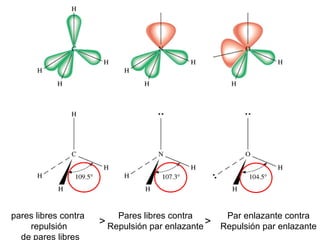
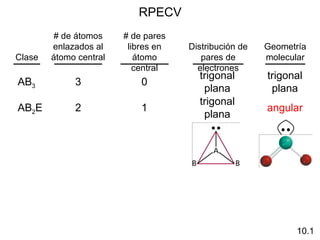
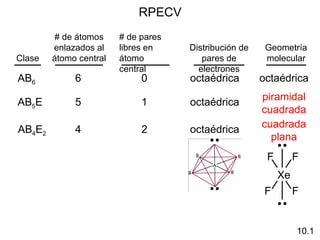
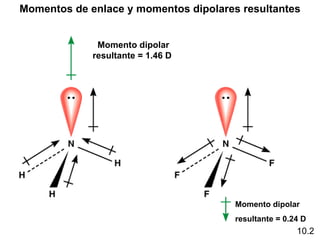
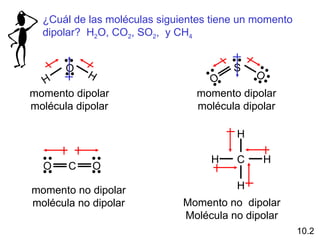
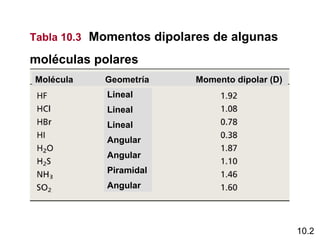
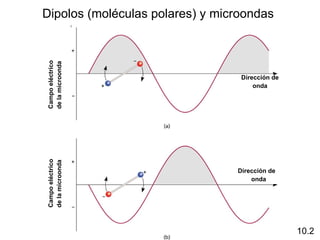
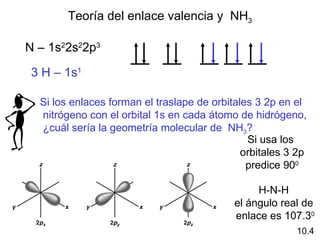
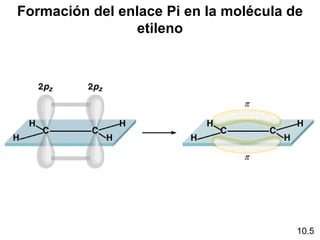
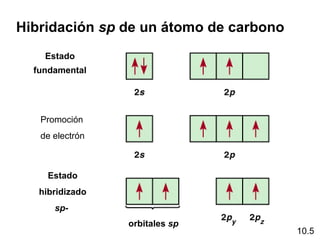
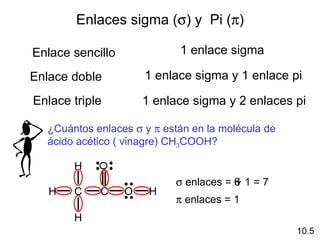
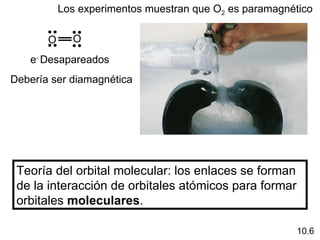
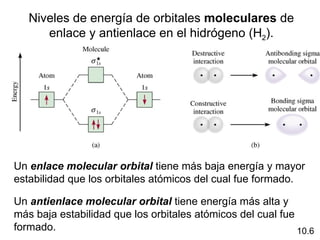
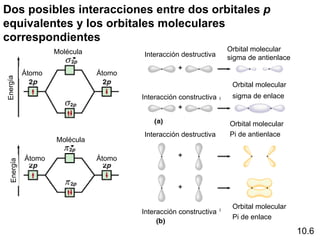
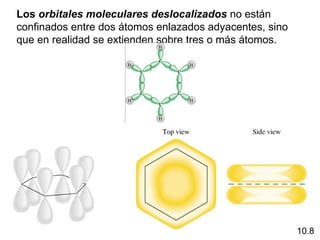
Este documento describe la teoría del modelo de repulsión de pares de electrones de la capa de valencia para predecir la geometría molecular basada en el número de átomos enlazados y pares de electrones libres en el átomo central. También cubre la hibridación de orbitales atómicos para explicar la geometría y enlaces en moléculas como metano, etileno y acetileno.