Factores que afectan la velocidad de una reaccion
•
0 recomendaciones•813 vistas
Este documento presenta los resultados de un experimento que estudió cómo dos factores, la concentración y la temperatura, afectan la velocidad de la reacción entre el ácido clorhídrico y el tiosulfato de sodio. Los resultados mostraron que a mayor concentración y temperatura, mayor era la velocidad de reacción.
Denunciar
Compartir
Denunciar
Compartir
Recomendados
Laboratorio de química # 3

La reacción entre HCl y una disolución de tiosulfato de sodio se descompone en agua, cloruro de sodio, azufre y dióxido de azufre. La velocidad de la reacción depende de factores como la concentración y temperatura de los reactivos. Un aumento en la concentración o temperatura de los reactivos aumenta la velocidad de la reacción al incrementar la probabilidad de colisiones entre moléculas.
Informe 2 (2)

Este informe de laboratorio describe dos experimentos que examinan cómo afectan la concentración y la temperatura a la velocidad de una reacción química entre ácido clorhídrico y tiosulfato de sodio. Los resultados muestran que a medida que aumenta la concentración de tiosulfato de sodio o la temperatura, aumenta la velocidad de reacción. El informe también incluye cálculos de velocidad de reacción y análisis de los resultados.
Lab de quimica Eira santamaria Ana Soto 

Este informe presenta los resultados de tres experimentos que examinan cómo afectan diferentes factores la velocidad de la reacción entre tiosulfato de sodio y ácido clorhídrico. El primer experimento encontró que la velocidad de reacción disminuye a medida que disminuye la concentración inicial de los reactivos. El segundo experimento determinó que la velocidad de reacción aumenta a medida que aumenta la temperatura de los reactivos. El tercer experimento confirmó que la temperatura y la concentración de los reactivos son fact
Velocidad de reaccion

Este documento describe un experimento realizado por estudiantes para investigar cómo la concentración y la temperatura afectan la velocidad de la reacción entre el tiosulfato de sodio y el ácido clorhídrico. Los estudiantes variaron la concentración del tiosulfato y la temperatura mientras medían el tiempo que tardaba la reacción en ocurrir. Observó que a mayor concentración y temperatura, mayor era la velocidad de la reacción.
Laboratorio n°3 hernán y daniel

Este documento describe un experimento para determinar cómo la temperatura y la concentración afectan la velocidad de la reacción entre el ácido clorhídrico y el tiosulfato de sodio. Los estudiantes variaron la temperatura de la mezcla de 10°C a 80°C y midieron el tiempo requerido para la formación del precipitado a diferentes concentraciones. Calculan la velocidad de reacción a diferentes temperaturas y concentraciones. Concluyen que la velocidad de reacción aumenta a medida que aumenta la temperatura o la concent
Lab 3 factores que afectan la velocidad de reacción Valery Liao Andoni Garrid...

Este informe describe un experimento que examina cómo la temperatura y la concentración afectan la velocidad de una reacción química. Se midió el tiempo que tardó la reacción entre el ácido clorhídrico y el tiosulfato de sodio al variar la concentración del tiosulfato y la temperatura. Los resultados mostraron que a mayor concentración y temperatura, la reacción ocurría más rápido, lo que confirma que la velocidad de reacción depende directamente de estos factores, de acuerdo con el
Laboratorio n°3 hernán y daniel

Este documento describe un experimento sobre los factores que afectan la velocidad de una reacción química. Se estudió la reacción entre el ácido clorhídrico y el tiosulfato de sodio variando la temperatura y la concentración inicial. Los resultados mostraron que la velocidad de la reacción aumenta a medida que aumenta la temperatura o la concentración inicial de los reactivos.
Lab 3 gabriel santos y edward taylor

Este reporte describe 3 experimentos realizados para determinar los factores que afectan la velocidad de una reacción. En el primer experimento, se prepararon diferentes disoluciones de tiosulfato de sodio y ácido clorhídrico cuya reacción produjo un precipitado amarillo. En el segundo, se varió la concentración inicial del tiosulfato y se midió el tiempo de reacción, observando que a menor concentración, menor era la velocidad. En el tercer experimento, al aumentar la temperatura de las disoluciones, la vel
Recomendados
Laboratorio de química # 3

La reacción entre HCl y una disolución de tiosulfato de sodio se descompone en agua, cloruro de sodio, azufre y dióxido de azufre. La velocidad de la reacción depende de factores como la concentración y temperatura de los reactivos. Un aumento en la concentración o temperatura de los reactivos aumenta la velocidad de la reacción al incrementar la probabilidad de colisiones entre moléculas.
Informe 2 (2)

Este informe de laboratorio describe dos experimentos que examinan cómo afectan la concentración y la temperatura a la velocidad de una reacción química entre ácido clorhídrico y tiosulfato de sodio. Los resultados muestran que a medida que aumenta la concentración de tiosulfato de sodio o la temperatura, aumenta la velocidad de reacción. El informe también incluye cálculos de velocidad de reacción y análisis de los resultados.
Lab de quimica Eira santamaria Ana Soto 

Este informe presenta los resultados de tres experimentos que examinan cómo afectan diferentes factores la velocidad de la reacción entre tiosulfato de sodio y ácido clorhídrico. El primer experimento encontró que la velocidad de reacción disminuye a medida que disminuye la concentración inicial de los reactivos. El segundo experimento determinó que la velocidad de reacción aumenta a medida que aumenta la temperatura de los reactivos. El tercer experimento confirmó que la temperatura y la concentración de los reactivos son fact
Velocidad de reaccion

Este documento describe un experimento realizado por estudiantes para investigar cómo la concentración y la temperatura afectan la velocidad de la reacción entre el tiosulfato de sodio y el ácido clorhídrico. Los estudiantes variaron la concentración del tiosulfato y la temperatura mientras medían el tiempo que tardaba la reacción en ocurrir. Observó que a mayor concentración y temperatura, mayor era la velocidad de la reacción.
Laboratorio n°3 hernán y daniel

Este documento describe un experimento para determinar cómo la temperatura y la concentración afectan la velocidad de la reacción entre el ácido clorhídrico y el tiosulfato de sodio. Los estudiantes variaron la temperatura de la mezcla de 10°C a 80°C y midieron el tiempo requerido para la formación del precipitado a diferentes concentraciones. Calculan la velocidad de reacción a diferentes temperaturas y concentraciones. Concluyen que la velocidad de reacción aumenta a medida que aumenta la temperatura o la concent
Lab 3 factores que afectan la velocidad de reacción Valery Liao Andoni Garrid...

Este informe describe un experimento que examina cómo la temperatura y la concentración afectan la velocidad de una reacción química. Se midió el tiempo que tardó la reacción entre el ácido clorhídrico y el tiosulfato de sodio al variar la concentración del tiosulfato y la temperatura. Los resultados mostraron que a mayor concentración y temperatura, la reacción ocurría más rápido, lo que confirma que la velocidad de reacción depende directamente de estos factores, de acuerdo con el
Laboratorio n°3 hernán y daniel

Este documento describe un experimento sobre los factores que afectan la velocidad de una reacción química. Se estudió la reacción entre el ácido clorhídrico y el tiosulfato de sodio variando la temperatura y la concentración inicial. Los resultados mostraron que la velocidad de la reacción aumenta a medida que aumenta la temperatura o la concentración inicial de los reactivos.
Lab 3 gabriel santos y edward taylor

Este reporte describe 3 experimentos realizados para determinar los factores que afectan la velocidad de una reacción. En el primer experimento, se prepararon diferentes disoluciones de tiosulfato de sodio y ácido clorhídrico cuya reacción produjo un precipitado amarillo. En el segundo, se varió la concentración inicial del tiosulfato y se midió el tiempo de reacción, observando que a menor concentración, menor era la velocidad. En el tercer experimento, al aumentar la temperatura de las disoluciones, la vel
Lab. cinetica quimica

Este informe de laboratorio presenta los resultados de un experimento sobre la cinética química de la reacción entre peróxido de hidrógeno y yoduro de potasio. Se determinó la ley de velocidad de la reacción individualmente y en grupo, calculando los índices x e y, la constante de velocidad k y la energía de activación. La reacción fue de segundo orden global y tuvo una energía de activación alta, lo que indica una velocidad lenta.
Practica 4 factores que afectan la velocidad de la reaccion

Este documento describe un experimento para estudiar cómo factores como la concentración, temperatura y naturaleza de los reactivos afectan la velocidad de una reacción química entre el tiosulfato de sodio y el ácido clorhídrico. El experimento varía sistemáticamente la concentración de tiosulfato de sodio y la temperatura de la mezcla reactiva mientras mide el tiempo requerido para la formación de un precipitado, permitiendo determinar la velocidad de reacción bajo diferentes condiciones.
Practica 4; cinetica quimica

1) El documento describe experimentos sobre la cinética química que estudian cómo afectan factores como la superficie de contacto, concentración y temperatura a la velocidad de reacción.
2) Los experimentos muestran que a mayor superficie de contacto, concentración o temperatura, la velocidad de reacción aumenta.
3) También se demostró que los catalizadores pueden incrementar la velocidad de reacción a temperaturas más bajas al disminuir la energía de activación.
Práctica N° 6 Factores que modifican la Velocidad de una Reacción Química

El documento describe cómo la concentración, temperatura, naturaleza de los reactivos y presencia de catalizadores afectan la velocidad de una reacción química. Explica que la velocidad aumenta con la concentración y temperatura debido a un mayor número de colisiones entre moléculas. También detalla experimentos para investigar los efectos de estos factores, midiendo el tiempo de reacción al variar la concentración del tiosulfato de sodio, la temperatura en la descomposición del ácido oxálico, y los diferentes metal
Velocidad de una reacción quimica

El documento analiza cómo factores como la naturaleza de los reactivos, la concentración y la superficie de contacto afectan la velocidad de una reacción química. Los experimentos mostraron que el ácido sulfúrico reacciona más rápido que el ácido clorhídrico y que la velocidad de reacción aumenta con la concentración del ácido. También se encontró que una sustancia con una superficie más grande, como el bicarbonato de calcio molido, reacciona más rápido que una sustancia con una
Factores que modifican_la_velocidad_de_un_cambio_quimico

Este documento describe un experimento para estudiar cómo afectan la concentración y la temperatura a la velocidad de una reacción química entre el ácido oxálico y el permanganato de potasio. Los estudiantes midieron el tiempo que tardaba la reacción al variar la concentración de los reactivos y elevar la temperatura, observando que a mayor concentración y temperatura, mayor era la velocidad de la reacción.
Química

Este documento resume los factores que afectan la velocidad de las reacciones químicas, incluyendo la concentración de los reactivos, la temperatura, el estado físico de los reactivos y la presencia de catalizadores. También describe el modelo de colisiones y cómo este explica cómo estos factores afectan la velocidad a través de la frecuencia, orientación y fuerza de las colisiones entre moléculas. Finalmente, discute cómo medir y determinar el orden de una reacción.
Laboratorio de Química #2 - Cinetica Química

Este documento presenta los resultados de un laboratorio de cinética química realizado por estudiantes de medicina en la Universidad de Panamá. El laboratorio examinó cómo factores como la temperatura, la concentración de reactivos y el tamaño de las partículas afectan la velocidad de la reacción química entre el bicarbonato de sodio y el agua. Los estudiantes encontraron que la reacción ocurrió más rápido a temperaturas más altas, con mayor concentración de vinagre y cuando el bicarbonato
REACCIÓN DE SEGUNDO ORDEN Y EFECTO DE LA TEMPERATURA

Reconocer que uno de los factores que afectan la velocidad de una reacción química es la temperatura y asociar un determinado valor de energía de activación a la reacción.
Informe cinetica-quimica

Este documento presenta un estudio cinético de la reacción entre el yodato de potasio y el sulfito de sodio. Los estudiantes determinaron experimentalmente cómo afectan la concentración de yodato de potasio y la temperatura a la velocidad de reacción a través de simulaciones. Los resultados mostraron que a mayor concentración de yodato de potasio, el tiempo de reacción es mayor, mientras que a mayor temperatura, el tiempo de reacción es menor.
Velocidad de reaccion

Este documento trata sobre la velocidad de reacción química. Explica la diferencia entre cinética y termodinámica, y que la cinética se ocupa de la velocidad de las reacciones y las variables que la afectan. También define la velocidad de reacción y la ecuación cinética, y explica conceptos como el orden de reacción, reacciones elementales vs. complejas, mecanismos e intermedios de reacción. Por último, cubre temas como la medición experimental de velocidades de reacción y la
CINETICA QUIMICA

Este documento resume los principales conceptos de la cinética química. Explica que la cinética química estudia la velocidad de las reacciones químicas y los factores que la afectan. Define la velocidad de reacción, distinguiendo entre velocidad media e instantánea. Describe teorías como la de colisiones y el complejo activado. Finalmente, detalla factores que influyen en la velocidad como la naturaleza de los reactivos, la temperatura, la concentración y la superficie de contacto.
Factores que modifican la velocidad de una reacción química

El documento describe tres experimentos realizados para investigar cómo afectan diferentes factores a la velocidad de una reacción química. El primer experimento estudia el efecto de la concentración al variar el volumen de Na2S2O3 en la reacción con HCl. El segundo experimento analiza el efecto de la temperatura al llevar a cabo la reacción entre H2C2O4 y KMnO4 a diferentes grados Celsius. El tercer experimento examina la naturaleza de los reactivos al medir el tiempo de reacción de Cu, Zn y
Factores que afecta la Velocidad de Reacción

El documento describe tres experimentos que estudian factores que afectan la velocidad de una reacción química entre tiosulfato de sodio y ácido clorhídrico. El primer experimento mide el tiempo de reacción a temperatura ambiente variando la concentración de tiosulfato. El segundo experimento mide el tiempo variando la temperatura y manteniendo las concentraciones constantes. Los resultados muestran que a mayor concentración o temperatura, menor es el tiempo de reacción y mayor la velocidad.
Quimica

Este documento resume los factores que afectan la velocidad de las reacciones químicas, incluyendo la concentración de los reactivos, la temperatura, el estado físico de los reactivos y la presencia de catalizadores. También describe el modelo de colisiones y cómo este explica cómo estos factores afectan la velocidad a través de la frecuencia, orientación y fuerza de las colisiones entre moléculas. Finalmente, discute cómo medir y determinar el orden de una reacción.
Cinética química

Este documento trata sobre la cinética química, que estudia la velocidad de las reacciones químicas y sus mecanismos. Explica factores que afectan la velocidad como la concentración de reactivos, temperatura y uso de catalizadores. También describe cómo medir experimentalmente la velocidad, leyes de velocidad, energía de activación, y teoría de colisiones para explicar reacciones a nivel molecular. Finalmente, presenta ejemplos de diferentes tipos de catalizadores y su papel en importantes procesos industri
Cinetica Quimica

Este documento trata sobre la cinética química. Explica que la cinética química estudia la velocidad de las reacciones químicas y los factores que afectan esta velocidad. Luego define la velocidad de reacción y explica que depende de la concentración de los reactivos y productos. Finalmente, enumera cinco factores que afectan la velocidad de reacción: la temperatura, la naturaleza de los reactivos, el grado de división, la concentración de los reactivos y el uso
Grupo2 práctica6 nrc1701

Este documento describe una práctica de laboratorio sobre la cinética química. La práctica verificó cómo la velocidad de una reacción depende de la naturaleza de los reactivos y la temperatura. Se midió el tiempo que tardaron en reaccionar el permanganato de potasio con el sulfato ferroso y el ácido oxálico a temperatura ambiente. Luego, se midió el tiempo de reacción del permanganato con el ácido oxálico a diferentes temperaturas. Los resultados mostraron que la velocidad de reacci
Práctica 2

Este documento describe experimentos para determinar cómo afectan la concentración, temperatura y catalizadores a la velocidad de una reacción química entre iones yodato y sulfito. Se realizaron experimentos variando la concentración y temperatura, y se midió el tiempo de reacción. Los resultados mostraron que la velocidad de reacción disminuye con menor concentración y aumenta con mayor temperatura. También se comprobó que un catalizador como el nitrato de cobre duplica la velocidad de reacción.
Factores que modifican la velocidad de un cambio químico

El documento describe una serie de experimentos para investigar cómo factores como la concentración, temperatura, naturaleza de los reactivos y catalizadores afectan la velocidad de una reacción química. Se realizan experimentos variando la concentración de tiosulfato de sodio, la temperatura en la descomposición del ácido oxálico por permanganato de potasio, y la naturaleza de los metales cobre, zinc y magnesio en su reacción con ácido clorhídrico, midiendo los tiempos de reacción en
Lab 3 (1)

Este documento presenta los resultados de un experimento sobre los factores que afectan la velocidad de una reacción química. El experimento estudió cómo la concentración de los reactivos y la temperatura influyen en el tiempo que tarda la reacción en ocurrir. Los resultados mostraron que a mayor concentración o temperatura, la reacción ocurría más rápido, en menos tiempo. Las conclusiones fueron que la concentración y la temperatura son factores que modifican la velocidad de las reacciones de manera directamente proporcional.
Informe de quimica 4

Este documento presenta los resultados de un experimento que estudia cómo afectan la concentración y la temperatura a la velocidad de una reacción química entre tiosulfato de sodio y ácido clorhídrico. Los resultados muestran que a mayor concentración de tiosulfato o temperatura, la velocidad de reacción es mayor, siendo directamente proporcionales ambos factores a la velocidad. Adicionalmente, se incluyen cálculos, gráficas y conclusiones de tres estudiantes sobre los hallazgos del experimento.
Más contenido relacionado
La actualidad más candente
Lab. cinetica quimica

Este informe de laboratorio presenta los resultados de un experimento sobre la cinética química de la reacción entre peróxido de hidrógeno y yoduro de potasio. Se determinó la ley de velocidad de la reacción individualmente y en grupo, calculando los índices x e y, la constante de velocidad k y la energía de activación. La reacción fue de segundo orden global y tuvo una energía de activación alta, lo que indica una velocidad lenta.
Practica 4 factores que afectan la velocidad de la reaccion

Este documento describe un experimento para estudiar cómo factores como la concentración, temperatura y naturaleza de los reactivos afectan la velocidad de una reacción química entre el tiosulfato de sodio y el ácido clorhídrico. El experimento varía sistemáticamente la concentración de tiosulfato de sodio y la temperatura de la mezcla reactiva mientras mide el tiempo requerido para la formación de un precipitado, permitiendo determinar la velocidad de reacción bajo diferentes condiciones.
Practica 4; cinetica quimica

1) El documento describe experimentos sobre la cinética química que estudian cómo afectan factores como la superficie de contacto, concentración y temperatura a la velocidad de reacción.
2) Los experimentos muestran que a mayor superficie de contacto, concentración o temperatura, la velocidad de reacción aumenta.
3) También se demostró que los catalizadores pueden incrementar la velocidad de reacción a temperaturas más bajas al disminuir la energía de activación.
Práctica N° 6 Factores que modifican la Velocidad de una Reacción Química

El documento describe cómo la concentración, temperatura, naturaleza de los reactivos y presencia de catalizadores afectan la velocidad de una reacción química. Explica que la velocidad aumenta con la concentración y temperatura debido a un mayor número de colisiones entre moléculas. También detalla experimentos para investigar los efectos de estos factores, midiendo el tiempo de reacción al variar la concentración del tiosulfato de sodio, la temperatura en la descomposición del ácido oxálico, y los diferentes metal
Velocidad de una reacción quimica

El documento analiza cómo factores como la naturaleza de los reactivos, la concentración y la superficie de contacto afectan la velocidad de una reacción química. Los experimentos mostraron que el ácido sulfúrico reacciona más rápido que el ácido clorhídrico y que la velocidad de reacción aumenta con la concentración del ácido. También se encontró que una sustancia con una superficie más grande, como el bicarbonato de calcio molido, reacciona más rápido que una sustancia con una
Factores que modifican_la_velocidad_de_un_cambio_quimico

Este documento describe un experimento para estudiar cómo afectan la concentración y la temperatura a la velocidad de una reacción química entre el ácido oxálico y el permanganato de potasio. Los estudiantes midieron el tiempo que tardaba la reacción al variar la concentración de los reactivos y elevar la temperatura, observando que a mayor concentración y temperatura, mayor era la velocidad de la reacción.
Química

Este documento resume los factores que afectan la velocidad de las reacciones químicas, incluyendo la concentración de los reactivos, la temperatura, el estado físico de los reactivos y la presencia de catalizadores. También describe el modelo de colisiones y cómo este explica cómo estos factores afectan la velocidad a través de la frecuencia, orientación y fuerza de las colisiones entre moléculas. Finalmente, discute cómo medir y determinar el orden de una reacción.
Laboratorio de Química #2 - Cinetica Química

Este documento presenta los resultados de un laboratorio de cinética química realizado por estudiantes de medicina en la Universidad de Panamá. El laboratorio examinó cómo factores como la temperatura, la concentración de reactivos y el tamaño de las partículas afectan la velocidad de la reacción química entre el bicarbonato de sodio y el agua. Los estudiantes encontraron que la reacción ocurrió más rápido a temperaturas más altas, con mayor concentración de vinagre y cuando el bicarbonato
REACCIÓN DE SEGUNDO ORDEN Y EFECTO DE LA TEMPERATURA

Reconocer que uno de los factores que afectan la velocidad de una reacción química es la temperatura y asociar un determinado valor de energía de activación a la reacción.
Informe cinetica-quimica

Este documento presenta un estudio cinético de la reacción entre el yodato de potasio y el sulfito de sodio. Los estudiantes determinaron experimentalmente cómo afectan la concentración de yodato de potasio y la temperatura a la velocidad de reacción a través de simulaciones. Los resultados mostraron que a mayor concentración de yodato de potasio, el tiempo de reacción es mayor, mientras que a mayor temperatura, el tiempo de reacción es menor.
Velocidad de reaccion

Este documento trata sobre la velocidad de reacción química. Explica la diferencia entre cinética y termodinámica, y que la cinética se ocupa de la velocidad de las reacciones y las variables que la afectan. También define la velocidad de reacción y la ecuación cinética, y explica conceptos como el orden de reacción, reacciones elementales vs. complejas, mecanismos e intermedios de reacción. Por último, cubre temas como la medición experimental de velocidades de reacción y la
CINETICA QUIMICA

Este documento resume los principales conceptos de la cinética química. Explica que la cinética química estudia la velocidad de las reacciones químicas y los factores que la afectan. Define la velocidad de reacción, distinguiendo entre velocidad media e instantánea. Describe teorías como la de colisiones y el complejo activado. Finalmente, detalla factores que influyen en la velocidad como la naturaleza de los reactivos, la temperatura, la concentración y la superficie de contacto.
Factores que modifican la velocidad de una reacción química

El documento describe tres experimentos realizados para investigar cómo afectan diferentes factores a la velocidad de una reacción química. El primer experimento estudia el efecto de la concentración al variar el volumen de Na2S2O3 en la reacción con HCl. El segundo experimento analiza el efecto de la temperatura al llevar a cabo la reacción entre H2C2O4 y KMnO4 a diferentes grados Celsius. El tercer experimento examina la naturaleza de los reactivos al medir el tiempo de reacción de Cu, Zn y
Factores que afecta la Velocidad de Reacción

El documento describe tres experimentos que estudian factores que afectan la velocidad de una reacción química entre tiosulfato de sodio y ácido clorhídrico. El primer experimento mide el tiempo de reacción a temperatura ambiente variando la concentración de tiosulfato. El segundo experimento mide el tiempo variando la temperatura y manteniendo las concentraciones constantes. Los resultados muestran que a mayor concentración o temperatura, menor es el tiempo de reacción y mayor la velocidad.
Quimica

Este documento resume los factores que afectan la velocidad de las reacciones químicas, incluyendo la concentración de los reactivos, la temperatura, el estado físico de los reactivos y la presencia de catalizadores. También describe el modelo de colisiones y cómo este explica cómo estos factores afectan la velocidad a través de la frecuencia, orientación y fuerza de las colisiones entre moléculas. Finalmente, discute cómo medir y determinar el orden de una reacción.
Cinética química

Este documento trata sobre la cinética química, que estudia la velocidad de las reacciones químicas y sus mecanismos. Explica factores que afectan la velocidad como la concentración de reactivos, temperatura y uso de catalizadores. También describe cómo medir experimentalmente la velocidad, leyes de velocidad, energía de activación, y teoría de colisiones para explicar reacciones a nivel molecular. Finalmente, presenta ejemplos de diferentes tipos de catalizadores y su papel en importantes procesos industri
Cinetica Quimica

Este documento trata sobre la cinética química. Explica que la cinética química estudia la velocidad de las reacciones químicas y los factores que afectan esta velocidad. Luego define la velocidad de reacción y explica que depende de la concentración de los reactivos y productos. Finalmente, enumera cinco factores que afectan la velocidad de reacción: la temperatura, la naturaleza de los reactivos, el grado de división, la concentración de los reactivos y el uso
Grupo2 práctica6 nrc1701

Este documento describe una práctica de laboratorio sobre la cinética química. La práctica verificó cómo la velocidad de una reacción depende de la naturaleza de los reactivos y la temperatura. Se midió el tiempo que tardaron en reaccionar el permanganato de potasio con el sulfato ferroso y el ácido oxálico a temperatura ambiente. Luego, se midió el tiempo de reacción del permanganato con el ácido oxálico a diferentes temperaturas. Los resultados mostraron que la velocidad de reacci
Práctica 2

Este documento describe experimentos para determinar cómo afectan la concentración, temperatura y catalizadores a la velocidad de una reacción química entre iones yodato y sulfito. Se realizaron experimentos variando la concentración y temperatura, y se midió el tiempo de reacción. Los resultados mostraron que la velocidad de reacción disminuye con menor concentración y aumenta con mayor temperatura. También se comprobó que un catalizador como el nitrato de cobre duplica la velocidad de reacción.
Factores que modifican la velocidad de un cambio químico

El documento describe una serie de experimentos para investigar cómo factores como la concentración, temperatura, naturaleza de los reactivos y catalizadores afectan la velocidad de una reacción química. Se realizan experimentos variando la concentración de tiosulfato de sodio, la temperatura en la descomposición del ácido oxálico por permanganato de potasio, y la naturaleza de los metales cobre, zinc y magnesio en su reacción con ácido clorhídrico, midiendo los tiempos de reacción en
La actualidad más candente (20)
Practica 4 factores que afectan la velocidad de la reaccion

Practica 4 factores que afectan la velocidad de la reaccion
Práctica N° 6 Factores que modifican la Velocidad de una Reacción Química

Práctica N° 6 Factores que modifican la Velocidad de una Reacción Química
Factores que modifican_la_velocidad_de_un_cambio_quimico

Factores que modifican_la_velocidad_de_un_cambio_quimico
REACCIÓN DE SEGUNDO ORDEN Y EFECTO DE LA TEMPERATURA

REACCIÓN DE SEGUNDO ORDEN Y EFECTO DE LA TEMPERATURA
Factores que modifican la velocidad de una reacción química

Factores que modifican la velocidad de una reacción química
Factores que modifican la velocidad de un cambio químico

Factores que modifican la velocidad de un cambio químico
Similar a Factores que afectan la velocidad de una reaccion
Lab 3 (1)

Este documento presenta los resultados de un experimento sobre los factores que afectan la velocidad de una reacción química. El experimento estudió cómo la concentración de los reactivos y la temperatura influyen en el tiempo que tarda la reacción en ocurrir. Los resultados mostraron que a mayor concentración o temperatura, la reacción ocurría más rápido, en menos tiempo. Las conclusiones fueron que la concentración y la temperatura son factores que modifican la velocidad de las reacciones de manera directamente proporcional.
Informe de quimica 4

Este documento presenta los resultados de un experimento que estudia cómo afectan la concentración y la temperatura a la velocidad de una reacción química entre tiosulfato de sodio y ácido clorhídrico. Los resultados muestran que a mayor concentración de tiosulfato o temperatura, la velocidad de reacción es mayor, siendo directamente proporcionales ambos factores a la velocidad. Adicionalmente, se incluyen cálculos, gráficas y conclusiones de tres estudiantes sobre los hallazgos del experimento.
Informe de quimica #4

Este documento presenta los resultados de un experimento que estudia cómo afectan la concentración y la temperatura a la velocidad de una reacción química entre tiosulfato de sodio y ácido clorhídrico. Los resultados muestran que a mayor concentración de tiosulfato o temperatura, la velocidad de reacción es mayor, siendo directamente proporcionales ambos factores a la velocidad. Adicionalmente, se incluyen cálculos, gráficas y conclusiones de tres estudiantes sobre los hallazgos del experimento.
Informe de quimica #4

Este documento presenta los resultados de un experimento que analizó cómo la temperatura y la concentración afectan la velocidad de una reacción química entre tiosulfato de sodio y ácido clorhídrico. Se observó que la velocidad de reacción aumenta a medida que la temperatura y la concentración de tiosulfato aumentan, por lo que ambos factores son directamente proporcionales a la velocidad. La reacción se detuvo cuando se formó el precipitado de azufre, permitiendo medir el tiempo de re
Cinetica

Parte de la química que se encarga de estudiar la velocidad o rapidez con la que ocurren las reacciones químicas, el mecanismo de cómo se consumen los reactantes y los factores que alteran la velocidad de una reacción química.
Equilibrio1

El documento describe un estudio sobre la influencia de la concentración en la velocidad de reacción entre yodato de potasio y bisulfito de sodio. El estudio midió el tiempo de reacción a diferentes concentraciones de yodato y determinó que la reacción es de primer orden, indicando que la velocidad aumenta a mayor concentración.
Factores que afectan la velocidad de una reacción

El documento describe un experimento que estudia cómo afectan la concentración y la temperatura a la velocidad de una reacción química entre tiosulfato de sodio y ácido clorhídrico. Se varió la concentración inicial de tiosulfato y la temperatura, midiendo en cada caso el tiempo que tardaba en formarse el precipitado. Los resultados mostraron que a menor concentración de tiosulfato o temperatura más baja, mayor era el tiempo de reacción.
Practica #7

El documento describe cuatro experimentos que analizan los factores que afectan la velocidad de una reacción química: concentración, temperatura, naturaleza de los reactivos y catalizadores. Los experimentos muestran que la velocidad de reacción aumenta con la concentración de los reactivos, la temperatura y para el cobre en comparación con el zinc y el magnesio.
CINETICA QUIMICA. Quimica General 2023.pdf

Este documento trata sobre la cinética química. Define la cinética química como la rama de la química que estudia la velocidad de reacción y los factores que la afectan. Explica conceptos como la energía de activación, el complejo activado y cómo estos determinan si una reacción es lenta o rápida. También describe factores que afectan la velocidad como la temperatura, concentración, y presencia de catalizadores.
Complem ejercicios.de.cinetica.quimica.con.solucion

Este documento presenta varios problemas y ejercicios relacionados con la cinética química. En el primer problema, se pide determinar las ecuaciones de velocidad para dos reacciones químicas específicas. En el segundo problema, se analizan los datos de velocidad de una reacción para determinar sus órdenes de reacción parciales y totales. El tercer problema sigue un procedimiento similar. Los problemas restantes implican completar tablas de datos cinéticos o determinar órdenes de reacción, constantes de veloc
Complem ejercicios.de.cinetica.quimica.con.solucion

Este documento presenta varios problemas y ejercicios relacionados con la cinética química. En el primer problema, se pide determinar las ecuaciones de velocidad para dos reacciones químicas específicas. En el segundo problema, se analizan los datos de velocidad de una reacción para determinar sus órdenes de reacción parciales y totales. El tercer problema sigue un procedimiento similar. Los problemas restantes presentan datos adicionales sobre reacciones químicas y piden determinar parámetros cinéticos como la const
Práctica n°01

Este documento describe un experimento para determinar el orden de reacción y la constante de velocidad de la descomposición de peróxido de hidrógeno catalizada por yoduro. El experimento involucra medir el volumen de oxígeno producido a diferentes temperaturas y usar los datos para calcular la constante de velocidad a cada temperatura. Luego, los valores de constante de velocidad se usan para determinar la energía de activación de la reacción, la cual se compara con el valor teórico reportado.
Equilibrio y cinetica quimica

Este documento trata sobre la cinética química y el equilibrio químico asociado a reacciones. Explica que la cinética química estudia la velocidad de las reacciones y los factores que la afectan, como la concentración y temperatura de los reactivos. También describe que las reacciones reversibles pueden alcanzar un estado de equilibrio donde las velocidades de formación de productos y descomposición de reactivos son iguales, lo que se conoce como equilibrio químico. Finalmente, introduce concept
1. INTRODUCCION A LA CINETICA FORMAL - Jorge Lujan -Jaramillo.pptx

Este documento presenta información sobre cinética química y diseño de reactores. Explica factores que influyen en la velocidad de reacción como la concentración, temperatura y catalizadores. También describe diferentes tipos de reacciones como homogéneas, heterogéneas y catalizadas. Finalmente, introduce conceptos clave como la ley de acción de masas y el orden de reacción.
Cinética química (2)

Este documento trata sobre la cinética química, que estudia la velocidad de las reacciones químicas. Explica que la velocidad depende de factores como la concentración de los reactivos, la temperatura, y la presencia de catalizadores. También describe cómo determinar experimentalmente la ley de velocidad de una reacción y el orden de reacción a partir de datos sobre la variación de la concentración con el tiempo.
Cinética quimica

Este documento trata sobre la cinética química. Explica que la cinética química estudia la velocidad de las reacciones químicas y los factores que afectan esta velocidad, como la temperatura, concentración de reactivos, estado físico y presencia de catalizadores. También describe mecanismos de reacción como la sustitución nucleofílica unimolecular y realiza un experimento para mostrar cómo cambia la velocidad de una reacción al variar la polaridad del disolvente.
SEMANA N°5 CINETICA QUÍMICA 2023 (1).pptx

......................................................................................................................................................
Clase ii b_cinetica_quimica

El documento resume los conceptos clave de la cinética química, incluyendo la velocidad de reacción, los factores que afectan la velocidad como la naturaleza de las sustancias, la concentración, la temperatura y los catalizadores. También explica el mecanismo de las reacciones a través de las teorías de colisiones y del estado de transición, así como el concepto de energía de activación.
Informe de reacciones i

El documento describe un estudio sobre el efecto de la concentración y la temperatura en la reacción química entre el carbonato de calcio y el ácido clorhídrico. Se realizaron seis corridas a 25°C, tomando el tiempo cada dos minutos y observando una disminución en la masa del carbonato de calcio con el paso del tiempo. El documento también explica los conceptos teóricos sobre cómo la velocidad de reacción depende de factores como la temperatura, la concentración y la energía de activación.
Similar a Factores que afectan la velocidad de una reaccion (19)
Complem ejercicios.de.cinetica.quimica.con.solucion

Complem ejercicios.de.cinetica.quimica.con.solucion
Complem ejercicios.de.cinetica.quimica.con.solucion

Complem ejercicios.de.cinetica.quimica.con.solucion
1. INTRODUCCION A LA CINETICA FORMAL - Jorge Lujan -Jaramillo.pptx

1. INTRODUCCION A LA CINETICA FORMAL - Jorge Lujan -Jaramillo.pptx
Último
El Cerebro se Cambia a si Mismo-Norman Doidge.pdf

Plasticidad cerebral; como el cerebro se puede cambiar a si mismo...
EVALUACION ESTUDIANTIL 2023-2024 Ecuador - Costa.pptx

Actualización de la Gestión Educativa en el ecuador 2023
FEEDBACK DE LA ESTRUCTURA CURRICULAR- 2024.pdf

José Luis Jiménez Rodríguez
Junio 2024.
“La pedagogía es la metodología de la educación. Constituye una problemática de medios y fines, y en esa problemática estudia las situaciones educativas, las selecciona y luego organiza y asegura su explotación situacional”. Louis Not. 1993.
p4s.co Ecosistema de Ecosistemas - Diagrama.pdf

Ofrecemos herramientas y metodologías para que las personas con ideas de negocio desarrollen un prototipo que pueda ser probado en un entorno real.
Cada miembro puede crear su perfil de acuerdo a sus intereses, habilidades y así montar sus proyectos de ideas de negocio, para recibir mentorías .
Manual de procedimiento para gráficos HC

Manual de usuario para elaborar gráficos en Hoja de cálculo de Google.
La necesidad de bienestar y el uso de la naturaleza.pdf

La necesidad de bienestar y el uso de la naturaleza
Triduo Eudista: Jesucristo, Sumo y Eterno Sacerdote; El Corazón de Jesús y el...

Triduo Eudista: Jesucristo, Sumo y Eterno Sacerdote; El Corazón de Jesús y el...Unidad de Espiritualidad Eudista
La Unidad Eudista de Espiritualidad se complace en poner a su disposición el siguiente Triduo Eudista, que tiene como propósito ofrecer tres breves meditaciones sobre Jesucristo Sumo y Eterno Sacerdote, el Sagrado Corazón de Jesús y el Inmaculado Corazón de María. En cada día encuentran una oración inicial, una meditación y una oración final.Último (20)
RETROALIMENTACIÓN PARA EL EXAMEN ÚNICO AUXILIAR DE ENFERMERIA.docx

RETROALIMENTACIÓN PARA EL EXAMEN ÚNICO AUXILIAR DE ENFERMERIA.docx
Nuevos espacios,nuevos tiempos,nuevas practica.pptx

Nuevos espacios,nuevos tiempos,nuevas practica.pptx
pueblos originarios de chile presentacion twinkl.pptx

pueblos originarios de chile presentacion twinkl.pptx
EVALUACION ESTUDIANTIL 2023-2024 Ecuador - Costa.pptx

EVALUACION ESTUDIANTIL 2023-2024 Ecuador - Costa.pptx
La vida de Martin Miguel de Güemes para niños de primaria

La vida de Martin Miguel de Güemes para niños de primaria
Guia para Docentes como usar ChatGPT Mineduc Ccesa007.pdf

Guia para Docentes como usar ChatGPT Mineduc Ccesa007.pdf
Inteligencia Artificial para Docentes HIA Ccesa007.pdf

Inteligencia Artificial para Docentes HIA Ccesa007.pdf
200. Efemerides junio para trabajar en periodico mural

200. Efemerides junio para trabajar en periodico mural
La necesidad de bienestar y el uso de la naturaleza.pdf

La necesidad de bienestar y el uso de la naturaleza.pdf
Triduo Eudista: Jesucristo, Sumo y Eterno Sacerdote; El Corazón de Jesús y el...

Triduo Eudista: Jesucristo, Sumo y Eterno Sacerdote; El Corazón de Jesús y el...
Factores que afectan la velocidad de una reaccion
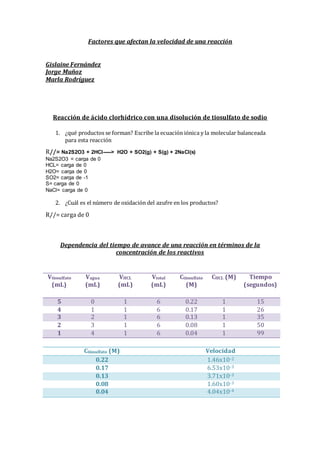
- 1. Factores que afectan la velocidad de una reacción Gislaine Fernández Jorge Muñoz Marla Rodríguez Reacción de ácido clorhídrico con una disolución de tiosulfato de sodio 1. ¿qué productos se forman? Escribe la ecuación iónica y la molecular balanceada para esta reacción R//= Na2S2O3 + 2HCl-----> H2O + SO2(g) + S(g) + 2NaCl(s) Na2S2O3 = carga de 0 HCL= carga de 0 H2O= carga de 0 SO2= carga de -1 S= carga de 0 NaCl= carga de 0 2. ¿Cuál es el número de oxidación del azufre en los productos? R//= carga de 0 Dependencia del tiempo de avance de una reacción en términos de la concentración de los reactivos Ctiosulfato (M) Velocidad 0.22 1.46x10-2 0.17 6.53x10-3 0.13 3.71x10-3 0.08 1.60x10-3 0.04 4.04x10-4 Vtiosulfato (mL) Vagua (mL) VHCL (mL) Vtotal (mL) Ctiosulfato (M) CHCL (M) Tiempo (segundos) 5 0 1 6 0.22 1 15 4 1 1 6 0.17 1 26 3 2 1 6 0.13 1 35 2 3 1 6 0.08 1 50 1 4 1 6 0.04 1 99
- 2. Análisis: Se puede ver en la gráfica que a medida que disminuía la concentración, la velocidad en la que se llevaba a cabo la reacción también disminuía. Dependencia dl tiempo de avance de una reacción en términos de la temperatura de los reactivos. Temperatura Tiempo(s) Velocidad(mol/L . s) °10 123 s 1.06x10-3 °20 95 s 1.36x10-3 °35 45 s 2,8x10-3 °50 36 s 3.6x10-3 °80 5 s 2,6x10-2 0 0.002 0.004 0.006 0.008 0.01 0.012 0.014 0.016 0.22 0.17 0.13 0.08 0.04 Velocidad Ctiosulfato(M) Velocidad Vs. Concentracion C1V1=C2V2 (0.26M)(2ml) = (4ml) C2 (0.26M)(2ml)/ (4ml) = C2 0.13 M =C2
- 3. Temperatura Velocidad °10 V= (0.13M)/123 s V=1.06x10-3 °20 V= (0.13M)/95 s V=1.36x10-3 °35 V= (0.13M)/45 s V=2,8x10-3 °50 V= (0.13M)/36 s V=3.6x10-3 °80 V= (0.13M)/5 s V=2,6x10-2 0 0.005 0.01 0.015 0.02 0.025 0.03 0 1 2 3 4 5 6 v(mol/LxS) t(s) V vs T Series1
- 4. Cuestionario 1. ¿Por qué la soluciónse enturbia a medida que pasa el tiempo? R/ la solución se enturbia debido a que la reacciónentre el tiosulfato de sodio y el ácido clorhídrico,deja comoresultado un precipitado amarillento de azufre,que aumenta su intensidad a medida que pasa el tiempo. 2. ¿Para qué se detiene el cronometro, cada vez,cuando se forma el precipitado? R/ Se detiene el cronometrocada vezque vemos que se forma el precipitado yaque en esta experiencia queremos ver como el factorcambia o afectala reacciónen el tiempo, es decir si causa que la reacción suceda conmayor rapidez o lo contrario que demore más. 3. ¿Por qué se mantiene constante el volumen de la disolución resultante de la mezcla? R./ El volumen de la disolución resultante se mantiene constante ya que si fueran de diferentes volúmenes esto seria otro factor que afectaría la velocidad en la que se lleva acabo la reacción. 4. ¿Por qué se varia solo la concentración inicial de tiosulfato y no también la de acido clorhídrico? R./ Solo varia la concentración del tiosulfato ya que la rapidez de una reacción se expresa con la concentración de uno de los reactivos. 5. ¿porque es necesario seguir temperando la solución cuando ocurre la reacción? R//= Es necesario seguir temperando la solución cuando ocurre la reacción para mantener el mismo efecto de la reacción dada ya que si varia la temperatura con la que se realizó la experiencia puede afectar el resultado obtenido 6. ¿Qué efecto tiene la temperatura sobre la velocidad con que ocurre la reacción para las mismas concentraciones iniciales? R//= La temperatura tiene el efecto de acelerar la velocidad de reacción debido que al aumentar la antes mencionada temperatura las partículas de las sustancias aumentan la velocidad de las mismas chocando unas con otras de modo que las reacciones se llevan de manera más rápida 7. calcular las velocidades obtenidas durante todo el experimento expresándolas en moles / L.S Velocidad de reacción de la 2° parte V= (0.22mol/L)/15 s =1.46x10-2mol/L.s V= (0.17mol/L)/26 s = 6.53x10-3mol/L.s V= (0.13mol/L)/35 s = 3.71x10-3mol/L.s V= (0.08mol/L)/50 s = 1.60x10-3mol/L.s V= (0.04mol/L)/99 s =4.04x10-4mol/L.s
- 5. Velocidad de reacción de la 3° parte V= (0.13mol/L)/123 s =1.06x10-3 mol/L.s V= (0.13mol/L)/95 s =1.36x10-3mol/L.s V= (0.13mol/L)/45 s =2,8x10-3 mol/L.s V= (0.13mol/L)/36 s =3.6x10-3 mol/L.s V= (0.13mol/L)/5 s =2,6x10-2mol/L.s Conclusión En esta experiencia pudimos ver dos de los factores que afectan en la velocidad en la que se da una reacción que son la concentración y la temperatura. Pudimos ver que a una mayor concentración la reacción se daba a acabo a una mayor velocidad y que a medida que bajaba la concentración, también bajaba la velocidad. En el caso de la temperatura, pudimos ver, que a medida que aumentaba la temperatura también aumentaba la velocidad ya que la energía cinética de las moléculas aumenta lo que hace que haya mayor probabilidad de que choquen entre si. -Gislaine Fernández En esta experiencia pudimos observar los factores que afectan la velocidad de una reacción, en este caso usamos 2 de los factores la concentración y la temperatura, En el cual con la concentración pudimos ver que entre mayor concentración mayor será la velocidad en la que se lleva a cabo la reacción, y a menor concentración; más lenta será la reacción. En cambio con la temperatura a mayor temperatura mayor es la velocidad de en la que se lleva la reacción debido a que las partículas se mueven a mayor velocidad. En fin pudimos ver a traves de graficas la dependencia del tiempo en una reacción. -Marla Rodríguez En este laboratorio pudimos observar y poder experimentar sobre los factores que afectan la velocidad de reacción teniendo en cuenta diversos factores, además de los órdenes de reacción que van de 0 a 2 y que sirve para la industria para cuando quieren hacer una reacción, además son fundamentales para el estudio de movimiento de partículas. -Jorge Muñoz
