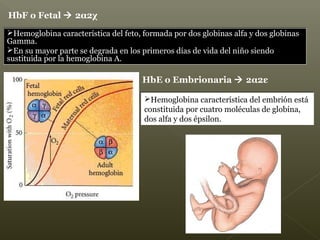
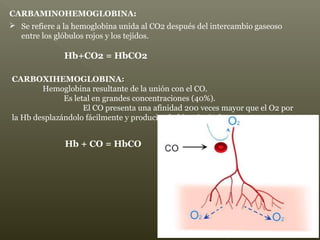
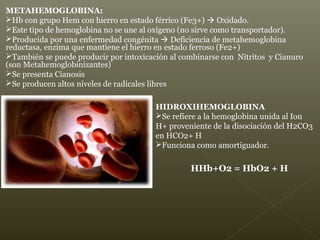
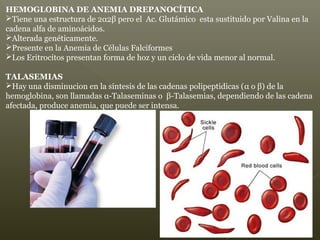
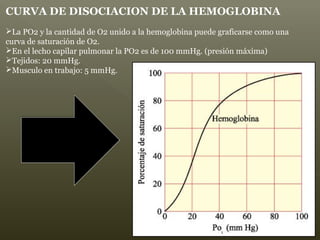
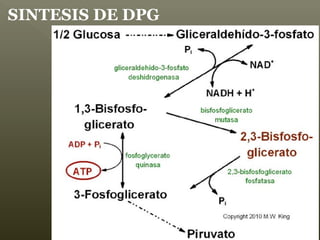
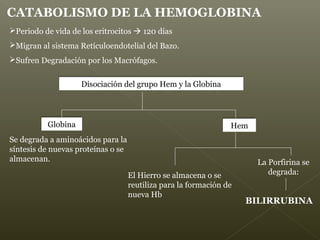
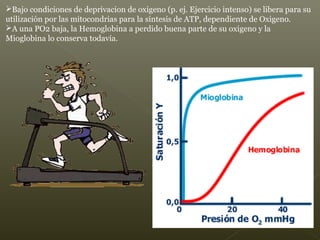
La hemoglobina es un pigmento respiratorio presente en los glóbulos rojos que les da su color rojo característico. Está formada por cuatro cadenas polipeptídicas unidas a cuatro grupos hemes con hierro ferroso, lo que le permite transportar oxígeno en la sangre. El hierro de los grupos hemes se une de forma reversible al oxígeno, dándole a la hemoglobina su funcionalidad para transportar oxígeno de los pulmones a los tejidos y dióxido de carbono de los tejidos a los