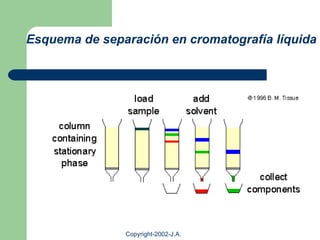
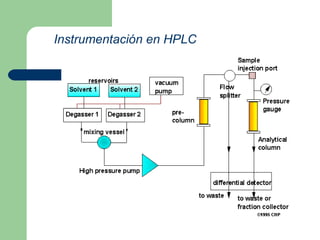
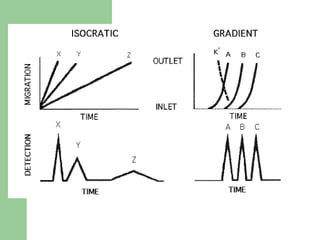
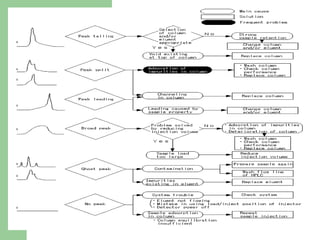
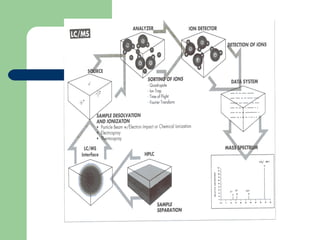
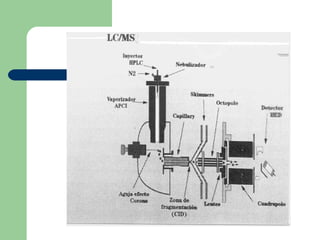
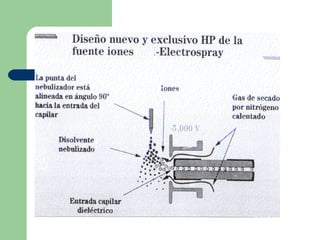
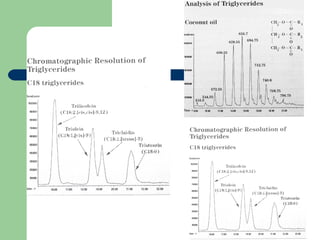
Este documento proporciona una introducción general a la cromatografía líquida de alta eficacia (HPLC). Describe los principales componentes de un sistema HPLC como las columnas, mecanismos de separación como adsorción, reparto e intercambio iónico, e instrumentación como detectores y acoplamiento con espectrometría de emisión atómica. También menciona diferentes tipos de interfases para conectar la HPLC con técnicas de detección elementales.