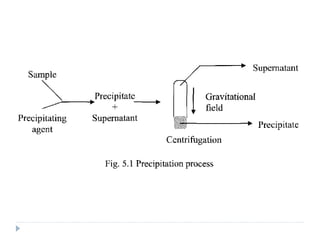
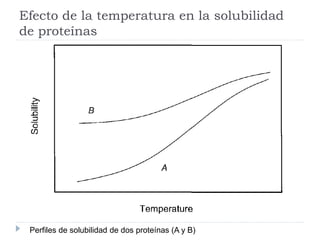
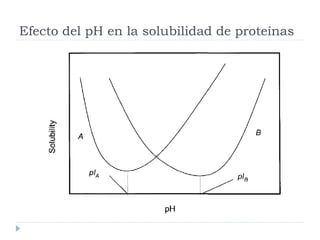
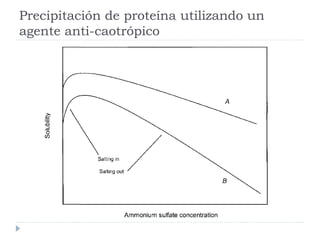
Este documento describe diferentes métodos de precipitación utilizados para purificar proteínas y ácidos nucleicos, incluyendo ajustes de temperatura, pH, adición de sales anti-caotrópicas y solventes orgánicos. Explica cómo estos factores pueden inducir la precipitación al exponer zonas hidrófobas o cubrir cargas electrostáticas, causando que las moléculas interaccionen y precipiten. También proporciona ejemplos comunes de sales y solventes utilizados, y cómo la constante dieléctrica afect



![ Las tres sales más comúnmente utilizadas
en precipitación son: sulfato de amonio
[(NH4)2SO4,] sulfato de sodio (Na2SO4) y
cloruro de sodio (NaCl).
Algunas sales caotrópicas: urea, guanidina
hidrocloruro
Estas sales actúan rompiendo enlaces de
hidrogéno intra-moleculares e interacciones
hidrofóbicas en proteínas.
Se utilizan principalmente para
replegamiento de proteínas, particularmente
en el procesamiento de cuerpos de
inclusión.
Las sales caotrópicas se utilizan en
purificación de ADN y ARN ya que
precipitan proteínas pero dejan a los ácidos](https://image.slidesharecdn.com/precipitacin-140801010139-phpapp01/85/Precipitacion-10-320.jpg)



