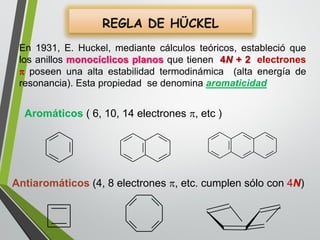
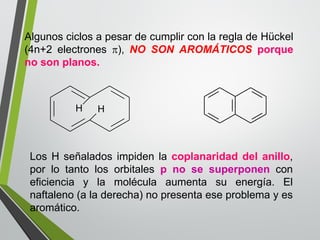
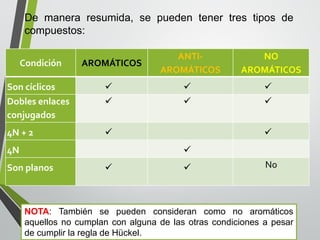
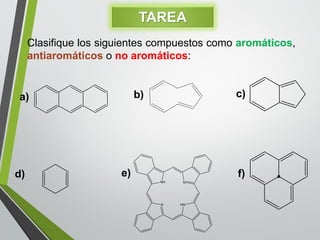
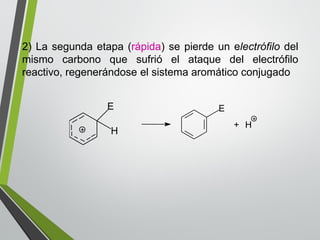
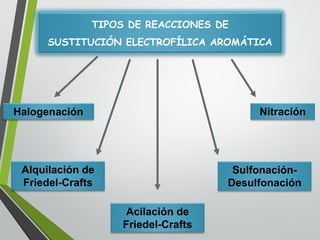
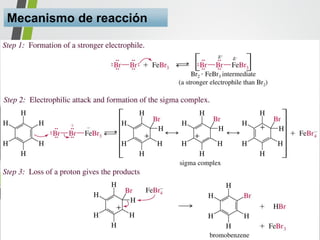
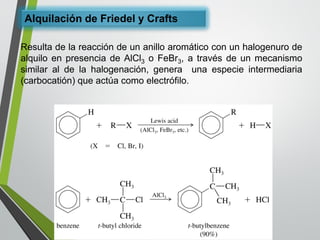
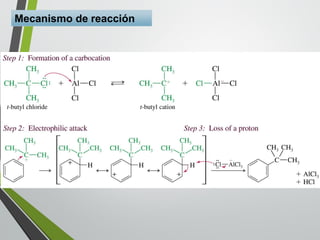
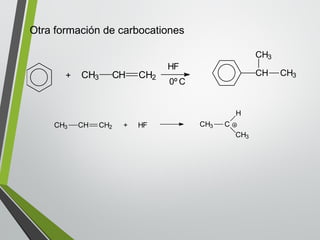
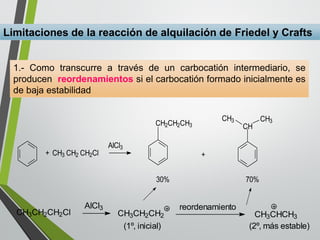
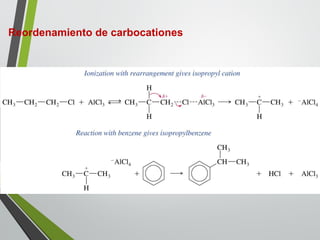
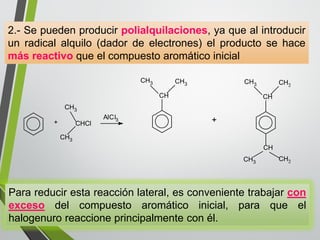
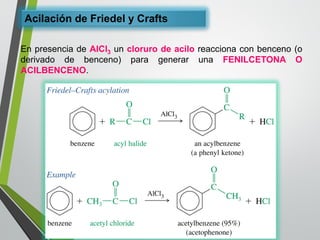
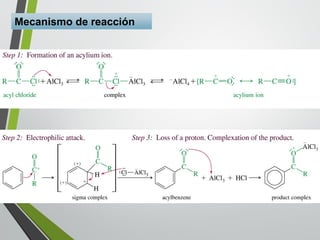
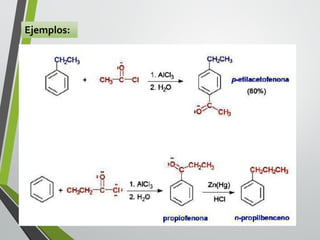
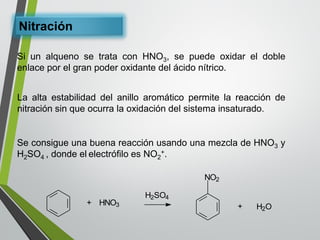
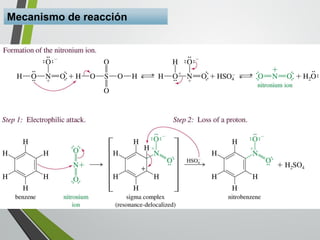
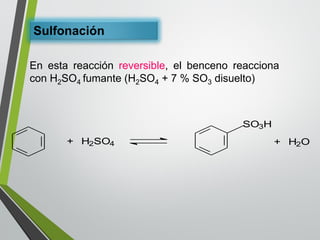
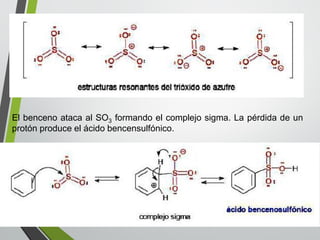
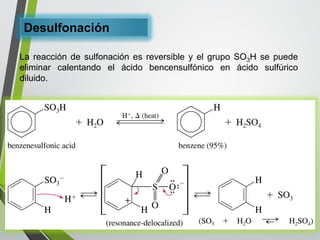
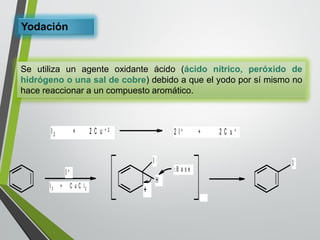
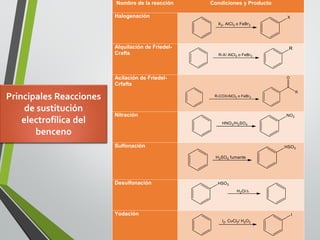
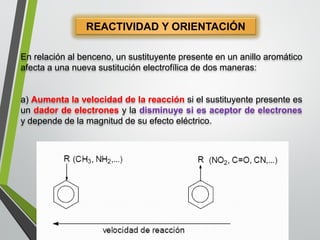
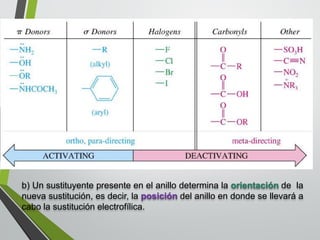
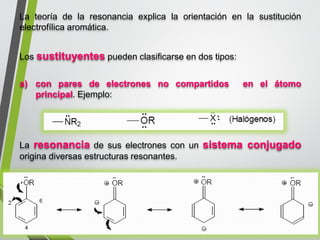
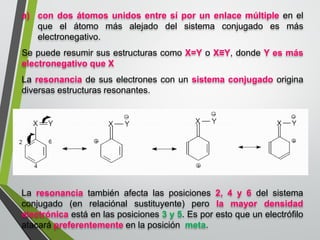
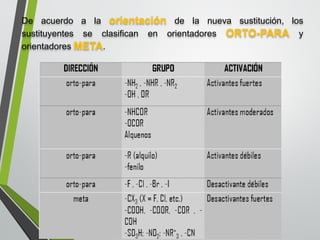
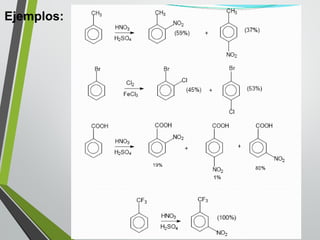
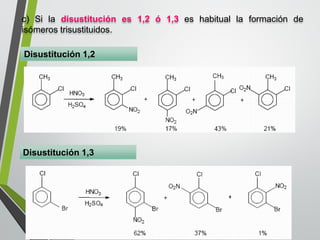
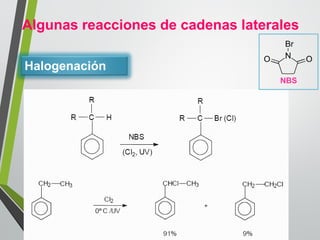
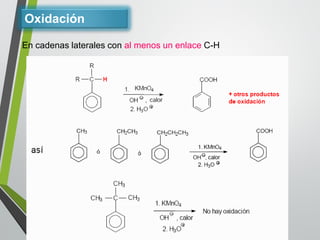
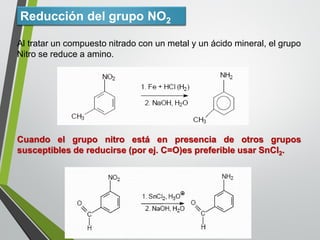
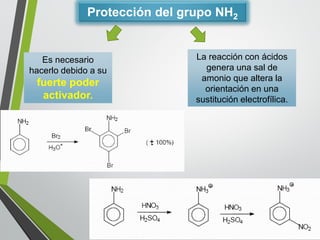
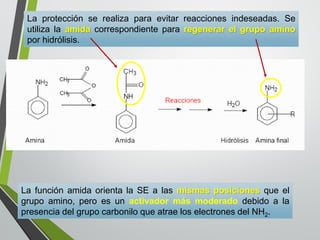
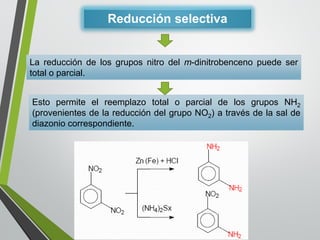
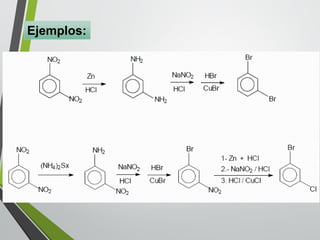
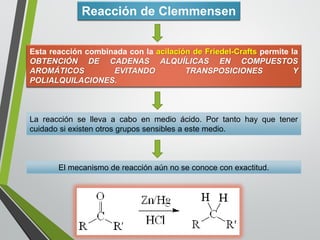
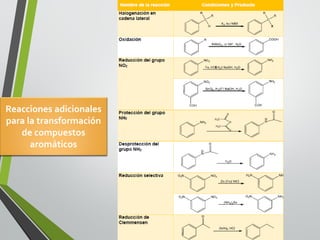
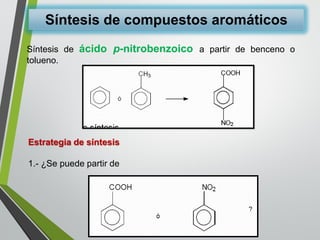
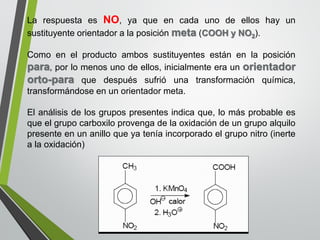
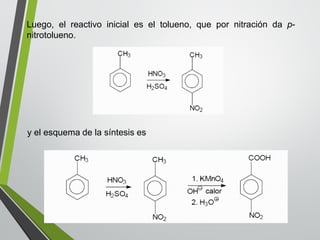
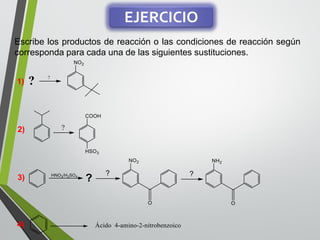
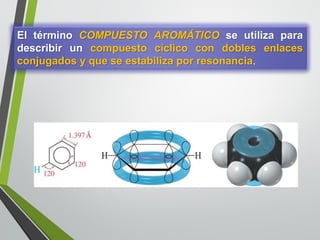
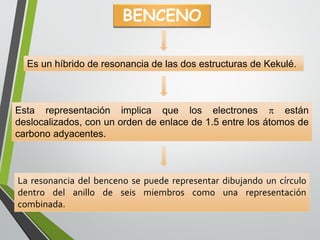
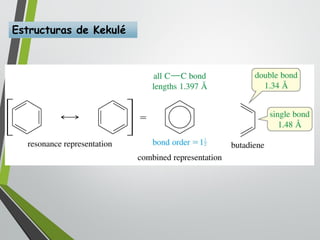
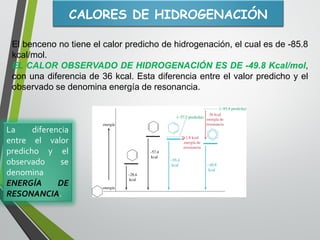
Este documento resume los conceptos clave de la aromaticidad y la reactividad de compuestos aromáticos como el benceno. Explica que el benceno es estable debido a la resonancia de sus electrones π y solo reacciona mediante sustitución electrofílica aromática. Describe reacciones como la halogenación, alquilación, acilación, nitración y sulfonación, así como cómo la orientación de sustituyentes afecta la reactividad. También presenta la regla de Hückel para determinar la aromaticidad basada en el número



![Aloshidrocarburoscíclicoscondoblesenlacesyenlacessencillosalternadosselesdenominaanulenos.Porejemplo,elbencenoesunanulenodeseismiembros,porloquetambiénseledenomina[6]anuleno.Elciclobutadienoesel[4]anuleno,elciclooctatetraenoesel[8]anulenoyasísucesivamente.
Paraqueuncompuestoseaaromáticodebeserunciclocondoblesenlacesconjugados,debeserplanoparapermitirquelosorbitalespsesolapenydebetenerunnúmero(4N+2)deelectrones.Elciclobutadienoyelciclooctatetraenonosonaromáticos
ANULENOS](https://image.slidesharecdn.com/iii-141113200809-conversion-gate02/85/III-aromaticos-8-320.jpg)