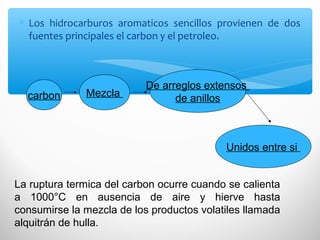
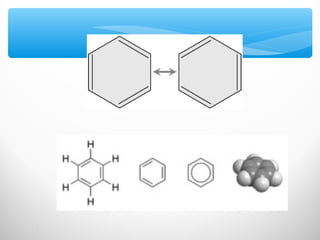
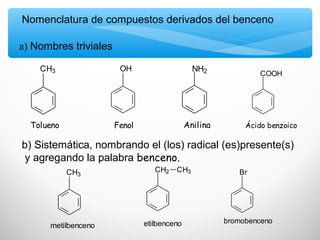
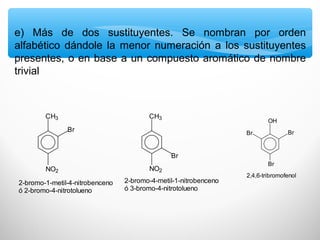
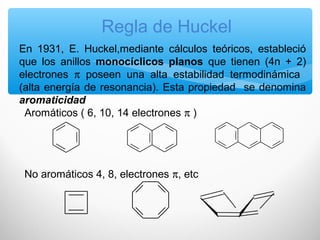
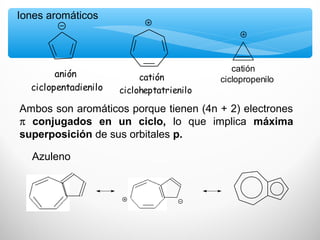
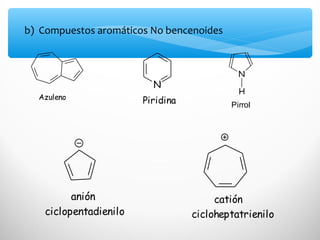
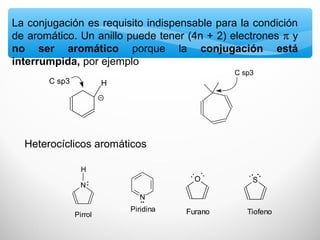
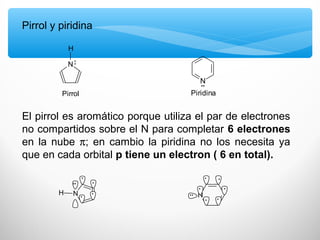
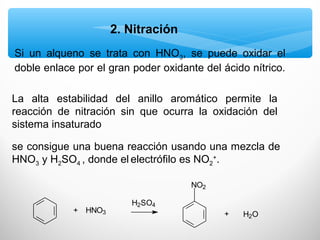
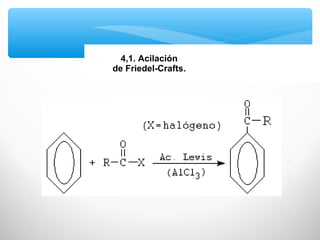
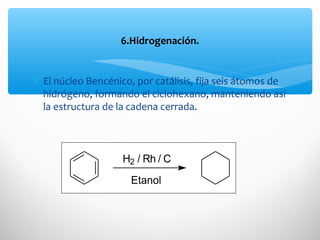
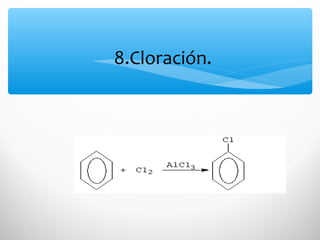
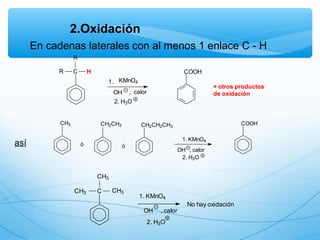
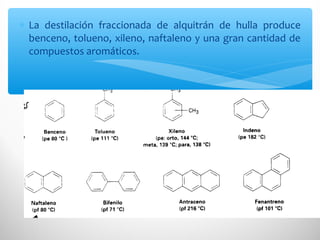
El documento describe las propiedades de los compuestos aromáticos como el benceno. Explica que el benceno es un hidrocarburo poliinsaturado con forma de anillo que cumple la regla de Hückel y es extremadamente estable. También describe las reacciones de sustitución electrofílica aromática que retienen la conjugación del anillo en lugar de reacciones de adición. Finalmente, resume que el benceno es un híbrido de resonancia cuya estructura es intermedia entre dos formas de enlace.